Immunothérapie
L’immunothérapie anticancéreuse désigne un ensemble de stratégies thérapeutiques visant à moduler la réponse immunitaire antitumorale. En inhibant les points de contrôle immunitaires (immune checkpoints) ou en activant les effecteurs lymphocytaires, elle permet de restaurer une immunosurveillance efficace. Cette approche a transformé la prise en charge de plusieurs tumeurs solides et hématologiques, notamment via les inhibiteurs de PD-1, PD-L1 et CTLA-4, ou les cellules CAR-T
En savoir plus sur la Immunothérapie
L'immunothérapie
L’immunothérapie constitue une révolution dans le traitement du cancer, utilisant le pouvoir naturel du système immunitaire pour prévenir, contrôler et éliminer les cellules cancéreuses . Contrairement à la chimiothérapie qui détruit directement les cellules tumorales, l’immunothérapie stimule ou restaure la capacité naturelle du système immunitaire à reconnaître et attaquer spécifiquement les tumeurs . Cette approche thérapeutique exploite le fait que les cellules cancéreuses présentent souvent des antigènes tumoraux, des molécules à leur surface qui peuvent se lier aux récepteurs des lymphocytes T, déclenchant ainsi une réponse immunitaire efficace .
Le système immunitaire possède naturellement la capacité de détecter et détruire les cellules anormales dans le cadre de l’immunosurveillance . Cependant, les cellules cancéreuses développent des stratégies d’échappement sophistiquées pour éviter cette surveillance . Elles peuvent présenter des changements génétiques qui les rendent moins visibles au système immunitaire, exprimer des protéines à leur surface qui inactivent les cellules immunitaires, ou modifier les cellules normales environnantes pour interférer avec la réponse immunitaire . L’immunothérapie vise précisément à lever ces blocages et à rendre au système immunitaire son efficacité contre le cancer .
Les objectifs de l’immunothérapie varient selon la situation clinique . Elle peut être utilisée pour interrompre ou ralentir la croissance du cancer, empêcher sa propagation à d’autres parties du corps, aider le système immunitaire à être plus efficace pour détruire les cellules cancéreuses, ou administrer des toxines directement aux cellules tumorales . Cette approche peut être employée seule ou en association avec d’autres traitements comme la chimiothérapie, la radiothérapie ou la chirurgie .
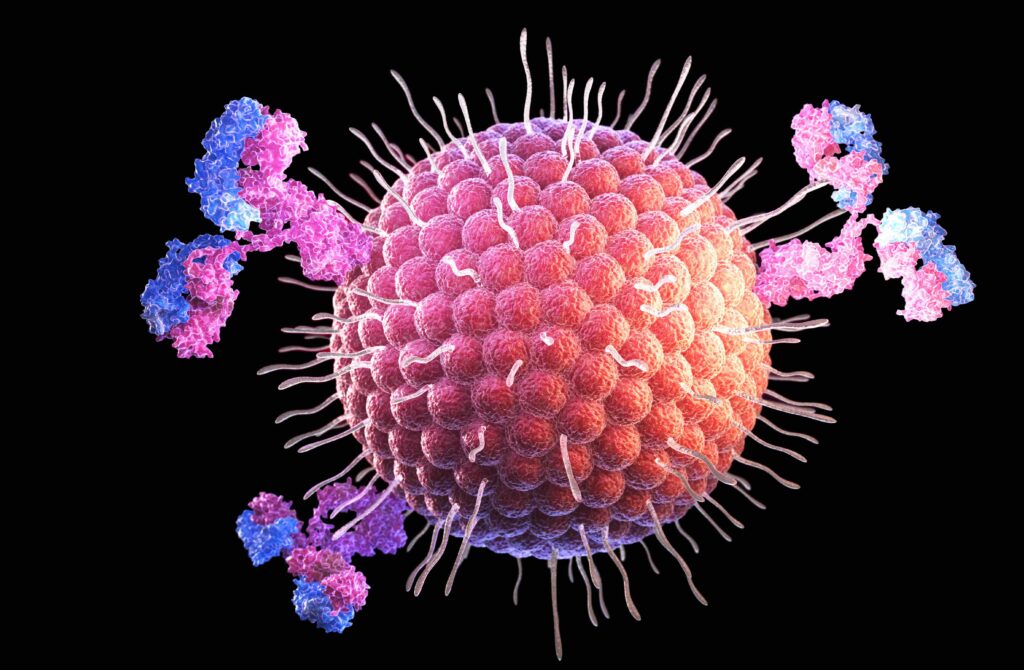
Comment fonctionne l'immunothérapie pour traiter le cancer ?
Le fonctionnement de l’immunothérapie repose sur une compréhension approfondie des mécanismes par lesquels le système immunitaire reconnaît et attaque les cellules cancéreuses . Les lymphocytes T constituent les acteurs cellulaires majeurs de l’immunosurveillance des cancers, patrouillant constamment dans l’organisme à la recherche de cellules anormales . Ces cellules utilisent des récepteurs spécialisés pour identifier les antigènes présentés à la surface des cellules et déterminer si elles représentent une menace.
Les Points de Contrôle Immunitaires
Les points de contrôle immunitaires fonctionnent comme des freins naturels du système immunitaire pour éviter que celui-ci ne s’attaque aux cellules saines . Ces protéines, comme PD-1 (Programmed cell Death protein 1) et PD-L1 (PD-1 ligand 1), jouent un rôle central dans la régulation de l’activité des lymphocytes T . Lorsque PD-1 à la surface d’un lymphocyte T interagit avec PD-L1 sur une cellule tumorale, cette liaison inactive le lymphocyte T et empêche l’attaque immunitaire .
Les cellules cancéreuses exploitent habilement ces mécanismes de contrôle pour échapper à la surveillance immunitaire . Elles peuvent surexprimer PD-L1 ou d’autres protéines de point de contrôle comme CTLA-4, trompant ainsi le système immunitaire qui les considère comme des cellules normales . Cette stratégie d’échappement permet aux tumeurs de croître et de se développer sans être inquiétées par les défenses naturelles de l’organisme.
Les Inhibiteurs de Points de Contrôle
Les inhibiteurs de points de contrôle représentent la classe d’immunothérapie la plus utilisée actuellement . Ces anticorps monoclonaux bloquent spécifiquement les protéines de point de contrôle, libérant ainsi les lymphocytes T de leurs contraintes et leur permettant de retrouver leur capacité d’attaque contre les cellules tumorales . Le pembrolizumab (Keytruda), le nivolumab (Opdivo), et l’ipilimumab (Yervoy) figurent parmi les inhibiteurs de checkpoints les plus prescrits.
Ces médicaments agissent en bloquant les interactions PD-1/PD-L1 ou CTLA-4, restaurant ainsi l’efficacité du système immunitaire contre les cellules cancéreuses . L’expression de PD-L1 par les cellules tumorales peut être mesurée durant l’analyse pathologique, bien que les niveaux d’expression de ce biomarqueur ne soient pas toujours corrélés avec la réponse immunothérapeutique.
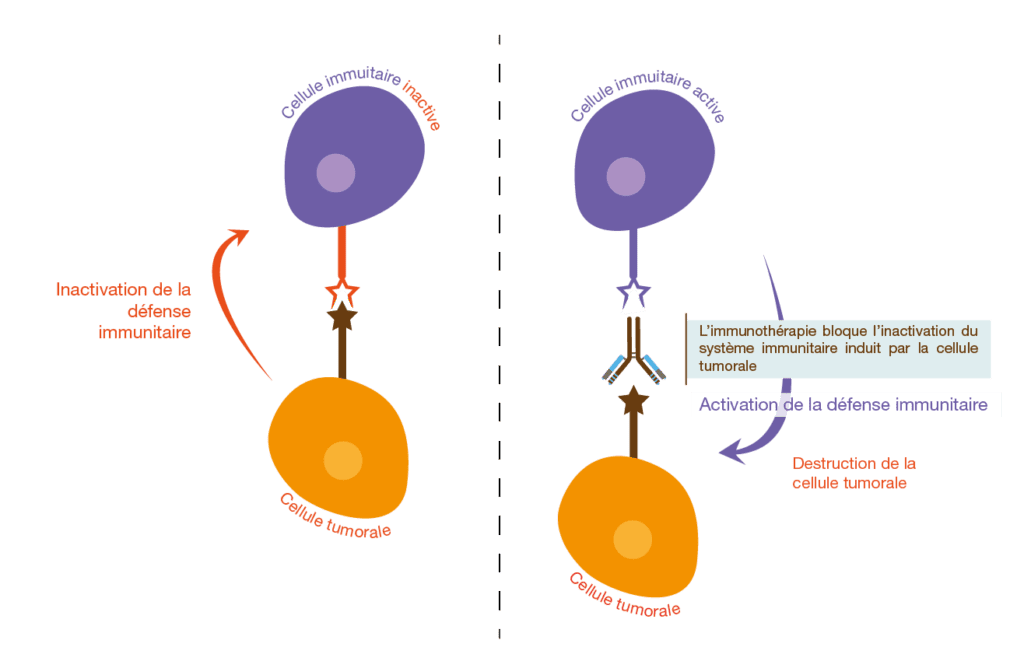
Administration de l’immunothérapie
L’administration de l’immunothérapie suit des protocoles précis et rigoureux adaptés à chaque médicament et situation clinique . La voie d’administration la plus courante est la perfusion intraveineuse, généralement réalisée dans des services d’oncologie spécialisés . Cette modalité d’administration permet une surveillance médicale constante et une intervention rapide en cas de réaction adverse.
Protocoles et Dosages
Chaque protocole d’immunothérapie définit précisément la dose du médicament, souvent calculée selon le poids corporel du patient, la fréquence d’administration, et la durée totale du traitement . Contrairement à la chimiothérapie traditionnelle, les doses d’immunothérapie sont fréquemment fixes et ne nécessitent pas d’ajustements constants en fonction des paramètres biologiques . Le mode d’administration, la dose et la fréquence dépendent du produit prescrit, du type de cancer et de l’état de santé du patient .
Les immunothérapies peuvent être utilisées en monothérapie ou associées à d’autres traitements . L’association avec la chimiothérapie, la radiothérapie ou les thérapies ciblées est fréquente et peut améliorer l’efficacité thérapeutique . Cette approche combinée nécessite une coordination précise entre les différents traitements pour optimiser les bénéfices tout en minimisant les interactions potentielles.
Préparation et Surveillance
La préparation des médicaments d’immunothérapie s’effectue par des pharmaciens spécialisés dans des unités sécurisées, avec un contrôle rigoureux à chaque étape . L’administration nécessite une surveillance médicale constante par une équipe soignante spécialisée qui vérifie la tolérance du patient et prévient les effets secondaires . Avant chaque séance, une consultation médicale évalue l’état général du patient et examine les résultats des analyses sanguines pour détecter d’éventuels effets indésirables.
Les réactions liées à la perfusion peuvent survenir pendant l’administration et nécessitent une surveillance particulière . L’équipe médicale est formée à reconnaître et traiter rapidement ces réactions pour assurer la sécurité du patient . Une surveillance cardiovasculaire spécifique peut être nécessaire, notamment pour détecter précocement une myocardite, complication rare mais grave des inhibiteurs de checkpoints .
Où et quand se passent les séances de l’immunothérapie ?
Les séances d’immunothérapie se déroulent principalement en hôpital de jour, dans des unités spécialisées équipées pour la surveillance des patients sous traitement anticancéreux . Ces espaces sont spécifiquement conçus pour le confort des patients, avec des fauteuils de perfusion adaptés et un environnement apaisant qui favorise la détente pendant le traitement . Les unités d’hôpital de jour offrent l’avantage de permettre aux patients de rentrer chez eux le jour même, préservant ainsi leur qualité de vie.
Durée et Rythme des Séances
La durée des perfusions d’immunothérapie varie généralement de 30 à 60 minutes selon le médicament administré . Cette durée relativement courte, souvent inférieure à celle des séances de chimiothérapie traditionnelle, représente un avantage significatif pour l’organisation de la vie quotidienne des patients . Le traitement est administré en perfusion toutes les 2 à 4 semaines, un rythme moins contraignant que de nombreux protocoles de chimiothérapie .
Le nombre total de cycles varie selon le protocole thérapeutique et la réponse du patient au traitement . Contrairement à la chimiothérapie qui suit généralement un nombre prédéfini de cycles, l’immunothérapie peut être poursuivie tant qu’elle demeure bénéfique et bien tolérée . Cette flexibilité permet une approche personnalisée du traitement, adaptée à l’évolution de chaque patient.
Hospitalisation à Domicile
L’hospitalisation à domicile représente une option émergente pour certains patients, après validation de leur tolérance au traitement lors des premières séances hospitalières . Cette modalité, coordonnée par l’équipe hospitalière et réalisée par des infirmières spécialisées, permet de recevoir le traitement dans le confort du domicile sans surcoût pour le patient . L’éligibilité à cette option dépend de critères stricts de sélection et nécessite un environnement domiciliaire approprié.
Chaque séance, qu’elle soit hospitalière ou à domicile, est précédée d’une consultation pour évaluer l’état général du patient et d’une prise de sang pour vérifier la tolérance biologique au traitement . Cette surveillance régulière permet de détecter précocement d’éventuels effets indésirables et d’adapter le traitement si nécessaire.
Recherche et immunothérapie
La recherche en immunothérapie connaît un développement exponentiel avec de nombreuses innovations prometteuses qui transforment progressivement le paysage thérapeutique oncologique . Les vaccins thérapeutiques contre le cancer représentent une approche émergente particulièrement prometteuse, visant à ‘éduquer’ le système immunitaire à reconnaître et attaquer spécifiquement les cellules tumorales . Ces vaccins peuvent être peptidiques, à ARN messager ou à vecteur viral, avec pour objectif d’entraîner les lymphocytes T à reconnaître les antigènes exprimés par les cellules tumorales .
Développements des Thérapies CAR-T
Les thérapies CAR-T évoluent vers de nouvelles générations plus efficaces et applicables à davantage de types de cancers, y compris les tumeurs solides . Les recherches actuelles portent sur l’amélioration de la persistance de ces cellules modifiées et la réduction de leurs effets secondaires . Des études récentes ont identifié le facteur de transcription FOXO1 comme régulateur maître de la programmation mémoire dans les CAR-T cells, ouvrant de nouvelles perspectives pour optimiser leur efficacité .
L’extension des CAR-T cells aux gliomes de haut grade montre des résultats encourageants, avec des essais cliniques démontrant la faisabilité et la sécurité de l’administration locorégionale . Ces avancées représentent un espoir majeur pour des cancers jusqu’alors considérés comme incurables .
Combinaisons Thérapeutiques et Médecine Personnalisée
Les combinaisons thérapeutiques associant différents types d’immunothérapies ou immunothérapie et traitements conventionnels montrent des résultats particulièrement encourageants . L’association d’inhibiteurs de checkpoints avec des agents antiangiogéniques, d’autres immunomodulateurs, ou des plateformes thérapeutiques innovantes comme les anticorps bispécifiques fait l’objet de recherches actives . L’étude ADRIATIC a récemment démontré qu’une immunothérapie anti-PD-L1 prolonge de près de deux ans l’espérance de vie des patients atteints de cancer du poumon à petites cellules .
La médecine personnalisée prend une importance croissante avec le développement de biomarqueurs prédictifs de réponse . Les tests génomiques des tumeurs permettent d’identifier les patients les plus susceptibles de bénéficier de l’immunothérapie, optimisant ainsi l’allocation des ressources thérapeutiques . Les recherches portent également sur l’identification de mécanismes de résistance et le développement de stratégies pour les contourner .
Innovations Émergentes
Les essais cliniques explorent de nouvelles cibles thérapeutiques et des approches innovantes comme les virus oncolytiques, qui détruisent sélectivement les cellules cancéreuses tout en stimulant l’immunité antitumorale . L’intelligence artificielle contribue également à optimiser les protocoles de traitement et prédire les réponses thérapeutiques . Les recherches sur les vaccins contre le cancer progressent avec des stratégies innovantes visant à surmonter les défis actuels et élargir les opportunités d’applications cliniques .
L’accessibilité de l’immunothérapie fait également l’objet d’attention particulière, compte tenu des coûts élevés de ces traitements . Le coût moyen d’un traitement complet d’immunothérapie expérimentale peut atteindre 30 000 à 40 000 dollars, avec des médicaments comme le pembrolizumab représentant une dépense de 72 000 euros par an et par patient . Des pistes sont explorées pour limiter ces coûts tout en préservant l’accès aux innovations thérapeutiques
Recherche et immunothérapie
L’immunothérapie présente un profil d’effets secondaires distinct de la chimiothérapie traditionnelle, nécessitant une surveillance médicale spécialisée . Les patients sous immunothérapie peuvent développer des réactions liées à l’immunité, telles que des inflammations ou des réactions auto-immunes, qui peuvent survenir à tout moment pendant le traitement, voire après son arrêt . Ces effets peuvent toucher tous les types d’organes, mais affectent plus fréquemment la peau, le côlon, les poumons, le foie et les organes endocriniens .
Les symptômes les plus couramment observés incluent la fatigue, les douleurs articulaires, les éruptions cutanées avec démangeaisons, les diarrhées, les nausées, et les troubles thyroïdiens . Ces effets indésirables sont généralement modérés et réversibles s’ils sont pris en charge rapidement . Une carte “Patient sous immunothérapie” est remise à toute personne bénéficiant de ce traitement pour informer tout professionnel de santé amené à la prendre en charge .
La surveillance médicale suit des protocoles précis adaptés au niveau de risque du patient, avec des examens cardiovasculaires, des ECG, des dosages de troponines et de peptides natriurétiques selon un calendrier défini . Les patients doivent se rendre régulièrement à des consultations médicales, avec des bilans toutes les 2 à 4 semaines et des scanners tous les 2 mois pour évaluer la réponse au traitement . Cette surveillance rapprochée permet de détecter précocement tout effet indésirable et d’assurer une prise en charge optimale
Les immunothérapies utilisées en France:
Nivolumab (Opdivo®)
Anti-PD-1
En savoir plus
Pembrolizumab (Keytruda®)
Anti-PD-1
En savoir plus
Atezolizumab (Tecentriq®)
Anti-PD-L1
En savoir plus
Durvalumab (Imfinzi®)
Anti-PD-L1
En savoir plus
Avelumab (Bavencio®)
Anti-PD-L1
En savoir plus
Ipilimumab (Yervoy®)
Anti-CTLA-4
En savoir plus
La France dispose aujourd’hui d’un arsenal thérapeutique complet en matière d’immunothérapie anticancéreuse, comprenant les inhibiteurs de points de contrôle immunitaires et les thérapies cellulaires CAR-T . Ces traitements révolutionnaires ont transformé la prise en charge de nombreux cancers depuis leur introduction sur le marché européen . L’immunothérapie représente désormais une pierre angulaire du traitement anticancéreux en France, avec une population cible estimée à environ 20 000 nouveaux patients par an.
Les Inhibiteurs de Points de Contrôle
Anti-PD-1 : Les Piliers de l’Immunothérapie Moderne
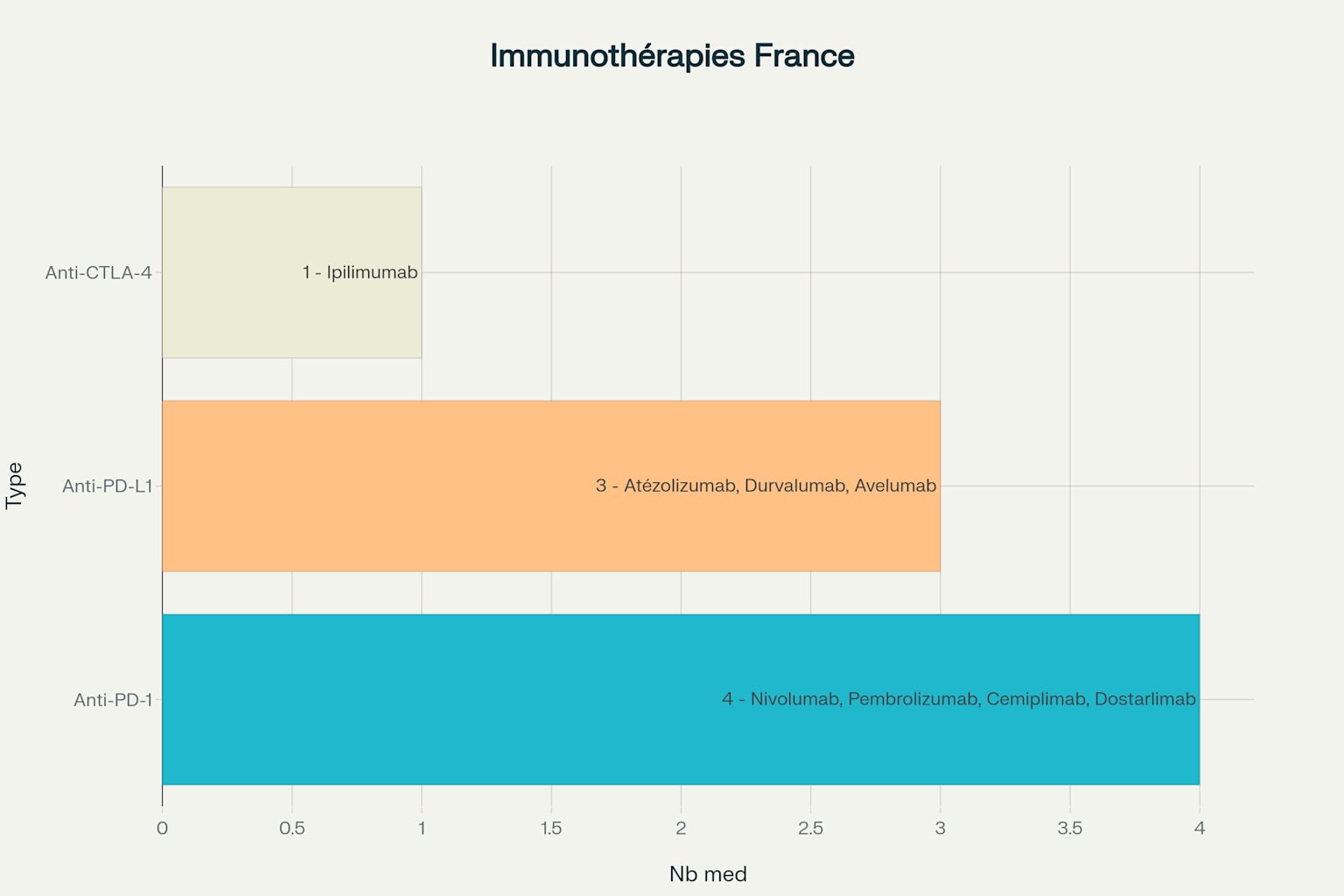
Les inhibiteurs anti-PD-1 constituent la classe d’immunothérapies la plus représentée en France, avec quatre médicaments actuellement disponibles . Le nivolumab (Opdivo®) et le pembrolizumab (Keytruda®), approuvés dès 2015, demeurent les références dans le traitement du mélanome avancé, du cancer du poumon non à petites cellules, et de nombreuses autres indications . Le pembrolizumab bénéficie d’un remboursement depuis 2017 pour le cancer du poumon, avec un coût de 6 000 euros par patient et par mois .
Plus récemment, le cemiplimab (Libtayo®) a obtenu son autorisation européenne en 2019 pour le traitement du carcinome épidermoïde cutané avancé . Le dostarlimab (Jemperli®), approuvé en 2021, représente une avancée majeure pour le cancer de l’endomètre, d’abord disponible en accès précoce puis remboursé en 2023
Anti-PD-L1 : Diversification des Approches Thérapeutiques
Les inhibiteurs anti-PD-L1 offrent une alternative thérapeutique importante avec trois médicaments disponibles . L’atézolizumab (Tecentriq®), approuvé en 2017, s’est particulièrement distingué dans le traitement adjuvant du cancer du poumon non à petites cellules . Le durvalumab (Imfinzi®) a révolutionné le traitement du cancer du poumon à petites cellules localement avancé, avec une prolongation de l’espérance de vie de près de deux ans selon l’étude ADRIATIC.
L’avelumab (Bavencio®) reste spécialisé dans le traitement du carcinome à cellules de Merkel métastatique, constituant la première immunothérapie approuvée pour cette indication rare .
Anti-CTLA-4 : Une Approche Complémentaire
L’ipilimumab (Yervoy®), premier inhibiteur de point de contrôle approuvé en Europe en 2011, conserve une place importante en association avec le nivolumab dans le traitement du mélanome avancé . Bien qu’il ait été radié de la liste en sus pour son indication en monothérapie dans le mélanome en 2018, il demeure essentiel dans les stratégies combinées .
Les Thérapies CAR-T : Innovation Cellulaire
Thérapies Anti-CD19
Les thérapies CAR-T ciblant l’antigène CD19 constituent le fer de lance de l’immunothérapie cellulaire en hématologie . Le Kymriah® (tisagenlecleucel) et le Yescarta® (axicabtagene ciloleucel), approuvés dès 2018, ont révolutionné le traitement des leucémies aiguës lymphoblastiques B et des lymphomes B . Une comparaison en vie réelle française a démontré une efficacité supérieure d’Yescarta avec un taux de réponse de 80% contre 66% pour Kymriah .
Le Tecartus® (brexucabtagene autoleucel), approuvé en 2020, répond spécifiquement aux besoins du lymphome du manteau réfractaire .
Thérapies Anti-BCMA pour le Myélome Multiple
L’Abecma® (idecabtagene vicleucel) et le Carvykti® (ciltacabtagene autoleucel), approuvés respectivement en 2021 et 2022, marquent l’entrée de l’immunothérapie cellulaire dans le traitement du myélome multiple . Ces thérapies ciblant l’antigène BCMA offrent de nouveaux espoirs aux patients en rechute ou réfractaires
Nos dernières actualités

Datroway : un nouvel espoir pour les patientes atteintes d’un cancer du sein triple négatif métastatique
AstraZeneca et Daiichi Sankyo viennent d’annoncer des résultats très encourageants pour Datroway, un nouveau médicament utilisé en 1ère ligne chez les patientes atteintes d’un cancer

Actualités de l’ESMO GI 2025 : Des Avancées Majeures pour les Patients Atteints de Cancers Digestifs
Du 2 au 5 juillet 2025, Barcelone a accueilli le Congrès ESMO sur les Cancers Gastro-intestinaux, rassemblant plus de 4 000 experts mondiaux pour présenter

Cancer urothélial métastatique : une avancée prouvée de la survie grâce aux immunothérapies et conjugués anticorps-médicaments
Le cancer urothélial, qui touche principalement la vessie mais aussi les autres parties du système urinaire, est une forme redoutée par sa tendance à s’étendre
