Click to edit this HTML5 Blcok for the interactive file
Cancer du sein
Le cancer du sein est une tumeur maligne qui se développe au niveau de la glande mammaire, représentant le cancer le plus fréquent chez la femme en France . Il résulte d'une prolifération anarchique de cellules issues des canaux galactophores (carcinomes canalaires) ou des lobules mammaires (carcinomes lobulaires)
En savoir plus sur la chimiothérapie
Qu’est-ce que le cancer du sein ?
Le cancer du sein est une tumeur maligne qui se développe à partir des cellules de la glande mammaire, le plus souvent à partir des canaux galactophores (carcinome canalaire) ou des lobules (carcinome lobulaire). Ces cellules cancéreuses peuvent rester localisées ou envahir les tissus voisins, puis se propager à distance via la circulation sanguine ou lymphatique, provoquant des métastases1,2.
Quelques chiffres clés (incidence, mortalité, guérison)
Incidence : Le cancer du sein est le cancer le plus fréquent chez la femme dans le monde et en France. En France, l’incidence a doublé entre 1990 et 2023, passant de 30 000 à plus de 61 000 nouveaux cas annuels, avec une augmentation moyenne de 0,3 % par an depuis 20103,4. Cela représente environ un tiers de tous les cancers féminins diagnostiqués chaque année5.
Mortalité : Le cancer du sein demeure la première cause de décès par cancer chez la femme en France, représentant 17,7 % de la mortalité par cancer féminin. En 2022, 14 739 femmes sont décédées d’un cancer du sein en France, ce qui place le pays au troisième rang européen pour la mortalité par cancer du sein5,4. Toutefois, la mortalité a nettement diminué ces trois dernières décennies grâce au dépistage et à l’amélioration des traitements, avec une baisse de 44 % depuis 1989 dans les pays occidentaux6,7.
Guérison et survie : Le taux de survie à 5 ans après un diagnostic de cancer du sein en France est de 87 à 88 %, contre 80 % en 1993, témoignant des progrès thérapeutiques. Ce taux atteint plus de 99 % pour les cancers localisés détectés précocement, mais chute à 87 % pour les formes régionales (atteinte ganglionnaire) et à 32 % pour les formes métastatiques8,9,4. La survie à long terme continue de s’améliorer, notamment grâce à la personnalisation des traitements et à l’intégration de nouvelles thérapies ciblées2,4.
Pourquoi en parler ? (importance du dépistage, tabous, impact social)
Importance du dépistage : Le dépistage organisé, principalement par mammographie, permet de détecter les cancers à un stade précoce, où les chances de guérison sont maximales. En France, les femmes de 50 à 74 ans sont invitées tous les deux ans à une mammographie gratuite, avec double lecture pour améliorer la fiabilité du diagnostic5,3. Les études montrent que les femmes participant régulièrement au dépistage ont un risque de décès par cancer du sein réduit de 26 %9. Malgré cela, le taux de participation reste sous-optimal, autour de 50 % en France, ce qui limite l’impact potentiel du programme5,3.
Tabous et impact social : Le cancer du sein est associé à de nombreux tabous, notamment liés à la féminité, à la sexualité et à l’image corporelle. L’annonce du diagnostic provoque souvent un choc psychologique, une anxiété, voire une dépression, qui peuvent impacter la vie familiale, sociale et professionnelle3. Le parcours de soins implique de nombreux acteurs (médecins, infirmières, psychologues, associations de patients), et la coordination est essentielle pour garantir une prise en charge globale et personnalisée3,2.
Enjeux de santé publique : Le cancer du sein mobilise d’importantes ressources médicales, de recherche et de prévention. Il est au cœur des plans nationaux de lutte contre le cancer, qui encouragent la multidisciplinarité, l’innovation thérapeutique et le soutien aux patientes5,3,4.
Références scientifiques
1 Yara D, Oroszi T. Understanding Breast Cancer: A Comprehensive Review of Epidemiology, Risk Factors, and Treatment Strategies. Adv Breast Cancer Res. 2025;14(1):1-17. doi:10.4236/abcr.2025.141001
2 Xiong X, et al. Breast cancer: pathogenesis and treatments. Signal Transduct Target Ther. 2025;10(1):1-22. doi:10.1038/s41392-024-02108-4
3 Rousset-Jablonski C, et al. French national survey on breast cancer care. PLoS One. 2024;19(4):e0286752. doi:10.1371/journal.pone.0286752
4 [2022: New therapeutic practices in breast oncology]. PubMed. 2023; GebFra. 84(6):529–540.
5 Transforming Breast Cancer Together. France – Infographic 2024.
6 Giaquinto AN, et al. Breast cancer statistics 2024. CA Cancer J Clin. 2024;74(4):307-322. doi:10.3322/caac.21867
7 American Cancer Society. New ACS Report: Breast Cancer Mortality Continues Three Decade Decline Overall, but Steeper Increases in Incidence for Women <50 & Asian American, Pacific Islanders of all Ages. 2024.
8 American Cancer Society. Breast Cancer Facts & Figures 2024-2025. (2024).
9 National Breast Cancer Foundation. Breast Cancer Facts & Stats 2024.
Anatomie et Fonctionnement du Sein
Anatomie du sein féminin
Le sein féminin est un organe complexe situé sur la paroi antérieure du thorax, en avant du muscle grand pectoral. Il est constitué de plusieurs types de tissus : glandulaire, fibreux (ligaments de Cooper), adipeux, vasculaire et nerveux1,2,3.
Tissu glandulaire : Le sein est composé de 15 à 20 lobes, chacun subdivisé en lobules, qui sont responsables de la production de lait lors de l’allaitement. Les lobules se terminent en petits bulbes sécréteurs.
Canaux galactophores : Les lobules sont reliés par des canaux (canaux galactophores) qui transportent le lait jusqu’au mamelon, situé au centre d’une zone pigmentée appelée aréole1,4,3.
Tissu adipeux : La majeure partie du volume du sein est constituée de tissu adipeux, qui donne la forme et la taille au sein et comble l’espace entre les différentes structures glandulaires1,4,5.
Fibres de soutien : Les ligaments de Cooper maintiennent la structure du sein et assurent son soutien1.
Vaisseaux sanguins et lymphatiques : Le sein est richement vascularisé par les artères mammaires interne et externe, et drainé par un réseau veineux superficiel et profond. Le système lymphatique comprend des vaisseaux et des ganglions situés principalement dans l’aisselle (ganglions axillaires), au-dessus et sous la clavicule, et autour du sternum (ganglions mammaires internes)2,3.
Innervation : Le sein est innervé principalement par les branches des nerfs intercostaux, assurant la sensibilité de la peau, de l’aréole et du mamelon2.
Le sein est divisé médicalement en quatre quadrants pour faciliter la localisation des anomalies. Le quadrant supéro-externe, situé vers l’aisselle, est la zone la plus fréquemment touchée par les cancers du sein6,7.
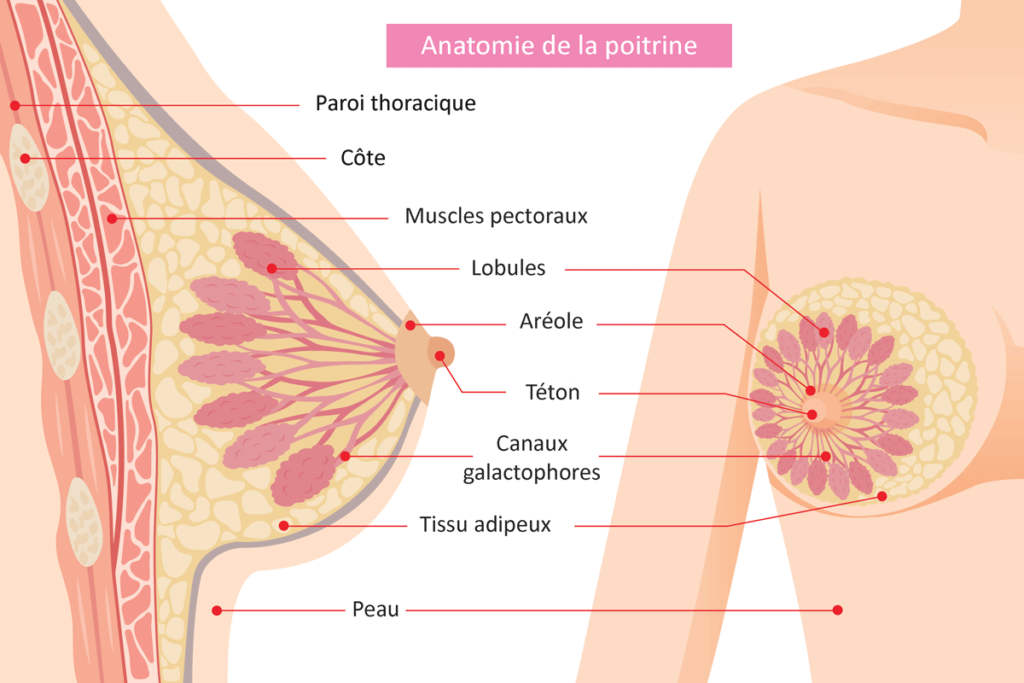
Anatomical illustration detailing the internal and external structures of the female breast, including lobules, ducts, and surrounding tissues. Source: acteurdemasante
Anatomie
Anatomie du sein masculin
Chez l’homme, le sein est constitué des mêmes structures de base (tissu adipeux, canaux, lobules, mamelon, aréole), mais en quantité beaucoup plus faible et non fonctionnelle1,8. Le tissu glandulaire reste rudimentaire, car il n’est pas stimulé par les hormones féminines. Toutefois, les hommes peuvent développer un cancer du sein, principalement au niveau des canaux galactophores1,8.
Développement et fonctionnement du sein
Le développement du sein débute à la puberté sous l’effet des hormones (œstrogènes, progestérone), qui stimulent la croissance des canaux et des lobules, ainsi que l’accumulation de tissu adipeux7. Au cours de la vie, la densité du tissu glandulaire diminue, remplacée progressivement par de la graisse, ce qui explique la moindre densité mammaire chez les femmes âgées7.
La fonction principale du sein est la lactation. Sous l’effet de la grossesse et de la stimulation hormonale, les lobules produisent du lait, qui est acheminé par les canaux jusqu’au mamelon1,7.
Comment se développe un cancer du sein ?
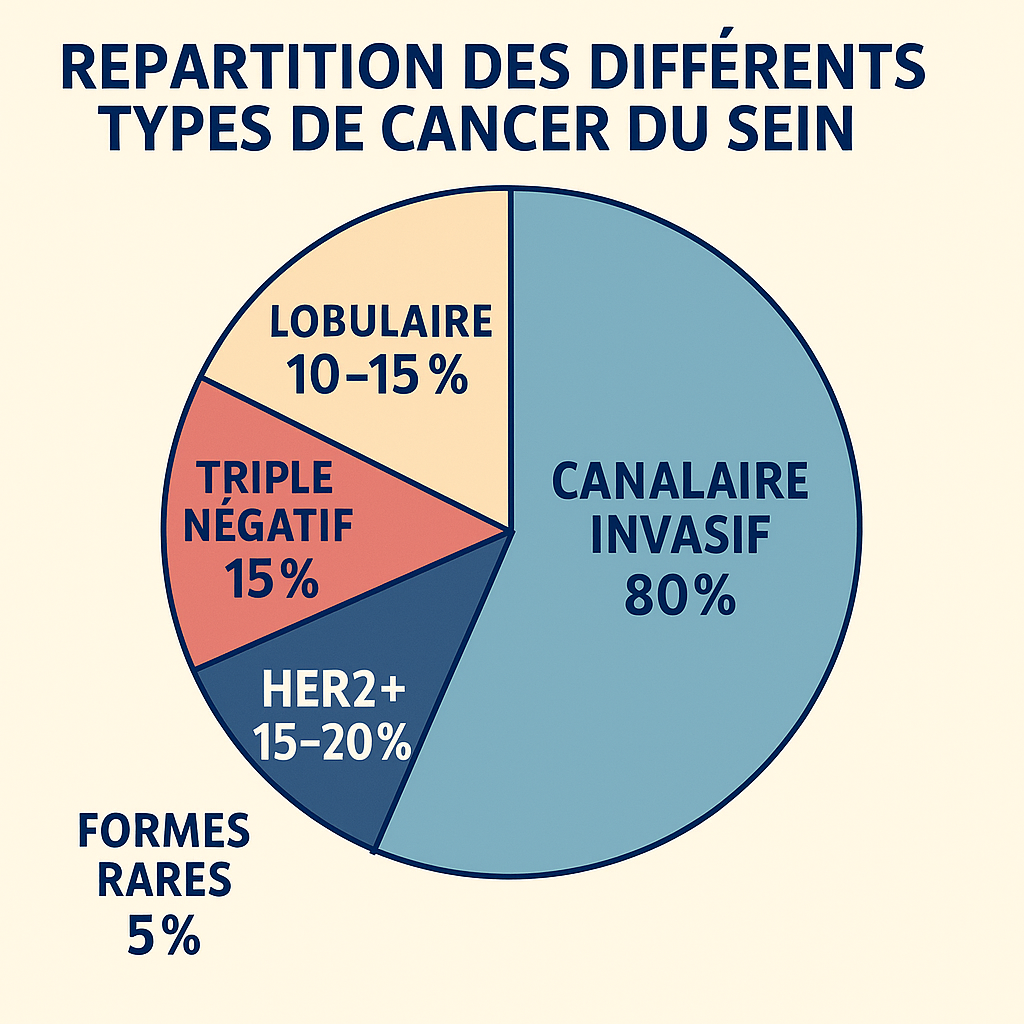
Le cancer du sein se développe principalement à partir des cellules épithéliales qui tapissent les canaux galactophores (80 % des cas) ou les lobules (10 à 15 % des cas)3.
Processus tumoral : L’apparition du cancer résulte d’une accumulation progressive de mutations génétiques dans les cellules du sein, souvent favorisée par l’âge, l’exposition à des agents mutagènes et des facteurs hormonaux4.
Transformation cellulaire : Les cellules normales acquièrent des anomalies génétiques qui perturbent les mécanismes de contrôle de la prolifération et de l’apoptose (mort cellulaire programmée). Lorsque ces systèmes de sécurité sont défaillants, la cellule se multiplie de façon incontrôlée, formant une tumeur4.
Caractéristiques des cellules cancéreuses : Elles deviennent immortelles, perdent leur fonction normale, détournent les ressources locales (néoangiogenèse) et échappent au système immunitaire4.
La majorité des cancers du sein sont donc des carcinomes, issus de cellules épithéliales, et se distinguent selon la structure atteinte (canalaire, lobulaire) et le degré d’invasion (in situ ou infiltrant)3.
Rôle des cellules souches mammaires
Des recherches récentes montrent que les cellules souches mammaires jouent un rôle clé dans le développement et le renouvellement de la glande mammaire. Leur dérégulation est impliquée dans la genèse de certains cancers du sein, ouvrant la voie à de nouvelles pistes thérapeutiques9.
Références :
1 Dépistage Sein Canada – Anatomie du sein
2 Dr Benhamou – Anatomie des seins
3 Cancer-environnement.fr – Fiche cancer du sein
4 Fondation ARC – Les cancers du sein (brochure scientifique)
5 Dr Mertens – Composition et anatomie du sein féminin
6 ISHH – Anatomie et pathologies du sein
7 Société canadienne du cancer – Les seins
8 Elsan – Anatomie des seins et pathologies
9 Fondation pour la Recherche Médicale – Explorer les mécanismes moléculaires du sein
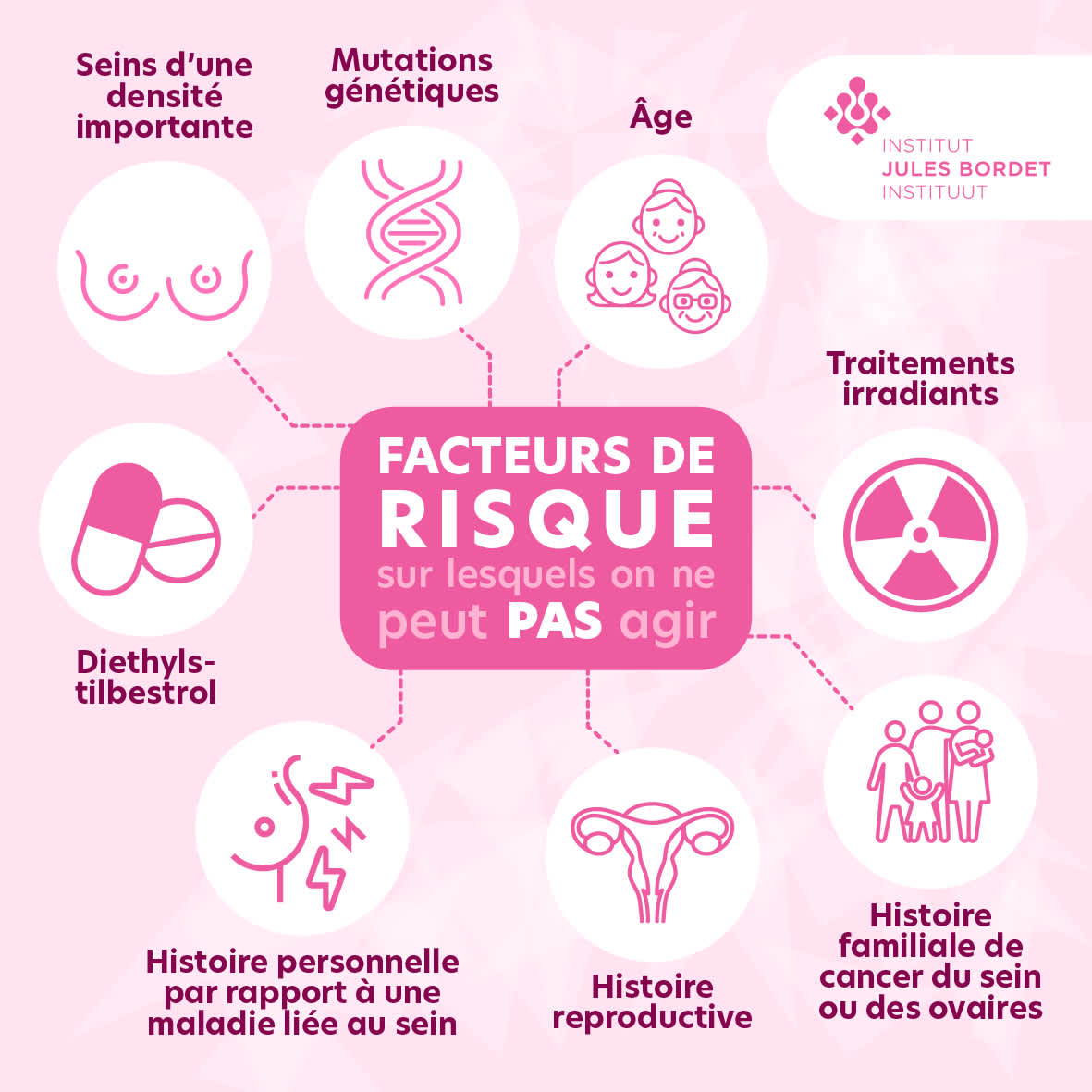
Facteurs de Risque du Cancer du Sein
Infographic illustrating non-modifiable risk factors for breast cancer, such as age, genetic mutations, and family history. Source: bordet
Facteurs génétiques (BRCA1, BRCA2…)
Les mutations génétiques héréditaires représentent 5 à 10% des cancers du sein . Les mutations BRCA1 confèrent un risque cumulé de 60% avant 70 ans, tandis que BRCA2 présente un risque de 55% . Le risque de cancer de l’ovaire atteint 59% pour BRCA1 et 16,5% pour BRCA2 . D’autres gènes comme PALB2 (35-40% de risque), TP53 (20-85%), et ATM (20-60%) sont également impliqués .
Facteurs hormonaux
L’exposition aux hormones sexuelles constitue un facteur majeur . Le risque augmente de 31% pour chaque doublement du taux d’œstradiol chez les femmes post-ménopausées . La progestérone joue un rôle plus déterminant que les œstrogènes . Les facteurs reproductifs incluent une ménarche précoce (risque multiplié par 2,83), la ménopause tardive, la nulliparité et l’âge tardif à la première grossesse .
Mode de vie et environnement
Alcool : Principal facteur modifiable, responsable de 15,1% des cas français . Relation dose-dépendante : +5% pour 0,5 verre/jour, +10% pour 1 verre/jour, +18% pour 2 verres/jour .
Tabac : Augmente le risque de 7% pour les fumeuses actuelles et 8% pour les anciennes fumeuses . Relation dose-réponse avec l’intensité (+12% pour 20 cigarettes/jour) et la durée (+5% pour 20 ans) .
Activité physique : Facteur protecteur réduisant le risque de 10% chez les femmes les plus actives . Protection maximale chez les femmes minces pratiquant >4h/semaine (-72%) .
Surpoids/Obésité : L’obésité post-ménopausique augmente le risque de 58% . Responsable de 10,6% des cas français chez les >50 ans .
Antécédents familiaux
Une parente au premier degré double le risque . Deux parentes multiplient le risque par 5 . Le risque varie selon le degré de parenté : +145% (1er degré), +82% (2e degré), +35% (3e degré) .
Âge et sexe
L’âge constitue le principal facteur : 80% des cas surviennent après 50 ans, 40% après 65 ans . Risque progressif : 1,5% à 40 ans, 3% à 50 ans, >4% à 70 ans . Le sexe féminin représente 99% des cas .
Facteurs environnementaux
Les polluants environnementaux contribuent à 16,7% des cas . Les perturbateurs endocriniens, pesticides et radiations ionisantes augmentent significativement le risque . L’exposition précoce aux radiations multiplie le risque par 2,5 .
Facteurs reproductifs
L’âge à la première grossesse influence le risque différemment selon les mutations génétiques . L’allaitement maternel exerce un effet protecteur dose-dépendant . Chez les porteuses BRCA1, 4 enfants ou plus réduisent le risque de 38% .
Références
Kuchenbaecker KB, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA. 2017;317(23):2402-2416.
Li S, et al. Risks of breast and ovarian cancer in BRCA1 and BRCA2 mutation carriers: a meta-analysis. Cancer Epidemiol Biomarkers Prev. 2024;33(4):512-525.
Yang X, et al. Cancer risks associated with germline PALB2 pathogenic variants: an international study. J Clin Oncol. 2020;38(7):674-685.
Key TJ, et al. Endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J Natl Cancer Inst. 2002;94(8):606-616.
Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk. Lancet. 2019;394(10204):1159-1168.
Collaborative Group on Hormonal Factors in Breast Cancer. Menarche, menopause, and breast cancer risk. Lancet. 2012;379(9826):1681-1692.
Shield KD, et al. Alcohol use and breast cancer: a critical review. Alcohol Clin Exp Res. 2016;40(6):1166-1181.
Bagnardi V, et al. Alcohol consumption and site-specific cancer risk: a comprehensive dose-response meta-analysis. Br J Cancer. 2015;112(3):580-593.
Jones ME, et al. Smoking and risk of breast cancer in the Generations Study cohort. Breast Cancer Res. 2017;19(1):118.
Moore SC, et al. Association of leisure-time physical activity with risk of 26 types of cancer in 1.44 million adults. JAMA Intern Med. 2016;176(6):816-825.
Thune I, et al. Physical activity and the risk of breast cancer. N Engl J Med. 1997;336(18):1269-1275.
Neuhouser ML, et al. Overweight, obesity, and postmenopausal invasive breast cancer risk. JAMA Oncol. 2015;1(5):611-621.
Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies. Lancet. 2001;358(9291):1389-1399.
Ferlay J, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359-386.
Siegel RL, et al. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):33-64.
Rodgers KM, et al. Environmental chemicals and breast cancer: an updated review of epidemiological literature informed by biological mechanisms. Environ Res. 2018;160:152-182.
Ronckers CM, et al. Radiation and breast cancer: a review of current evidence. Breast Cancer Res. 2005;7(1):21-32.
Kotsopoulos J, et al. Breastfeeding and the risk of breast cancer in BRCA1 and BRCA2 mutation carriers. Breast Cancer Res. 2012;14(2):R42.
Signes et Symptômes à Surveiller

Common signs and symptoms of breast cancer, including nipple discharge, lumps, skin changes, and breast asymmetry. Source: miye
Masse ou boule dans le sein ou sous l’aisselle
La découverte d’une masse palpable constitue le symptôme le plus fréquent du cancer du sein, représentant 83% des symptômes de présentation selon une large étude prospective britannique portant sur 2 316 femmes atteintes de cancer du sein 1. Cette masse présente des caractéristiques spécifiques qui permettent de distinguer les lésions suspectes des anomalies bénignes. Les masses malignes sont généralement décrites comme dures, irrégulières, et fermement attachées au tissu mammaire environnant 2.
Les caractéristiques échographiques des masses suspectes incluent une forme plus haute que large (valeur prédictive positive de 74-81%), des spiculations (valeur prédictive positive de 90%), et des microlobulations avec une valeur prédictive positive d’environ 50% 3. L’examen clinique mammaire présente une spécificité de 99,4% chez les femmes à risque moyen et de 97,1% chez celles à risque élevé pour le dépistage 4. Cependant, la sensibilité reste limitée, particulièrement pour les petites lésions non palpables.
Caractéristiques des masses malignes : Les tumeurs cancéreuses sont généralement asymptomatiques (indolores) au début, contrairement aux masses bénignes qui peuvent être sensibles ou douloureuses 5. L’étude de corrélation entre les différentes méthodes d’évaluation montre que l’échographie est le meilleur prédicteur de la taille tumorale réelle, avec une corrélation supérieure à l’examen clinique et à la mammographie 6. Les masses suspectes présentent souvent des contours angulaires, une hypoéchogénicité marquée, et un ombrage acoustique postérieur 3.
Ganglions lymphatiques : L’examen des ganglions axillaires fait partie intégrante de l’évaluation clinique, car 27 patientes (1,2%) dans l’étude britannique se sont présentées avec une masse axillaire comme symptôme principal 1. Les ganglions suspects sont généralement fermes, non mobiles, et peuvent être palpables sous l’aisselle, au-dessus ou sous la clavicule 7.
Changements de la peau (peau d’orange, rougeur)
Les modifications cutanées constituent des signes d’alerte majeurs du cancer du sein, particulièrement associées au cancer inflammatoire du sein, une forme rare mais agressive représentant environ 1-2% des cancers mammaires 8. L’aspect “peau d’orange” (peau d’orange) résulte de l’accumulation de liquide dans les couches superficielles de la peau due au blocage des vaisseaux lymphatiques par les cellules cancéreuses 9.
Cancer inflammatoire du sein : Cette forme particulière se caractérise par un développement rapide des symptômes en 3 à 6 mois, incluant un œdème cutané, une rougeur affectant plus d’un tiers du sein, un épaississement ou capitonnage cutané donnant l’aspect de peau d’orange 8. L’étude clinique révèle que 119 patientes (65,4%) avec cancer du sein et atteinte cutanée non inflammatoire présentaient des modifications cutanées classiques incluant ulcération, œdème, peau d’orange, et nodules satellites 10.
Rougeur et inflammation : La rougeur persistante, l’augmentation de température locale, et la sensation de lourdeur constituent des signes d’alarme 11. Ces symptômes peuvent initialement être confondus avec une mastite, particulièrement chez les femmes en période d’allaitement, mais l’absence d’amélioration sous antibiotiques dans les 7 à 10 jours doit faire suspecter un cancer inflammatoire 8.
Dimpling et capitonnage : Les modifications de la texture cutanée incluent les plis, rétraction, ou dimpling, qui peuvent indiquer la présence d’une tumeur sous-jacente tirant sur les ligaments de Cooper 12. Le dimpling affecte généralement un seul sein dans le contexte cancéreux, contrairement aux modifications bilatérales qui suggèrent plutôt des causes bénignes 12.
Modification du mamelon
Les anomalies du mamelon représentent 7% des symptômes de présentation du cancer du sein selon l’étude britannique prospective 1. Ces modifications incluent la rétraction mamelonnaire, les changements de position, les altérations de forme ou de couleur, et l’apparition d’eczéma ou de desquamation 5.
Rétraction mamelonnaire : La rétraction ou inversion récente du mamelon constitue un signe d’alarme majeur, particulièrement si elle est unilatérale et d’apparition récente 8. Cette rétraction résulte de la traction exercée par une tumeur sous-jacente sur les structures canalaires 13. L’examen clinique doit différencier une rétraction congénitale stable d’une modification récente.
Maladie de Paget : Les changements cutanés du mamelon et de l’aréole peuvent révéler une maladie de Paget du sein, caractérisée par des croûtes, ulcérations, ou desquamation de la région mamelonnaire 14. Cette forme rare de cancer se présente souvent sous forme d’eczéma persistant du mamelon résistant aux traitements dermatologiques habituels 11.
Asymétrie et changements de forme : L’évaluation clinique doit noter toute asymétrie récente entre les deux mamelons, tout changement de direction ou aplatissement du mamelon 15. L’examen en différentes positions (bras levés, mains sur les hanches) permet de révéler des modifications subtiles de la forme ou de la position 2.
Écoulement anormal
L’écoulement mamelonnaire pathologique mérite une évaluation spécialisée, bien que la majorité des écoulements ne soit pas liée à un cancer 16. Une méta-analyse portant sur 3 110 patientes a démontré que l’écoulement sanglant présente un risque relatif de cancer de 2,27 comparé aux écoulements non sanglants 17.
Écoulement sanglant : L’écoulement sanglant ou séro-sanglant constitue le facteur prédictif le plus significatif de malignité 18. L’étude italienne sur 915 patientes opérées pour écoulement mamelonnaire a révélé un cancer chez 30,3% des femmes avec écoulement sanglant contre 17,6% pour les écoulements séreux 18. Même les écoulements considérés comme “bénins” (séreux, colorés, séro-sanglants) présentent un risque de cancer non négligeable 18.
Caractéristiques suspectes : Les écoulements unilatéraux, spontanés, et issus d’un seul canal galactophore nécessitent une investigation 16. L’étude britannique sur 86 patientes opérées pour écoulement mamelonnaire isolé (sans masse palpable) a révélé seulement 2 cas de malignité occulte (2,3%), suggérant qu’un écoulement isolé présente un faible risque de cancer 16.
Évaluation diagnostique : L’examen cytologique de l’écoulement présente une spécificité élevée pour le diagnostic de cancer, justifiant son utilisation systématique 18. L’excision sélective du canal galactophore reste l’étalon-or diagnostique avec la sensibilité et spécificité les plus élevées 18.
Autres signes cliniques
Douleur mammaire : Contrairement aux idées reçues, la douleur mammaire (mastalgie) peut accompagner le cancer du sein chez 6,4% des patientes selon l’étude britannique 1. Cependant, la douleur isolée sans autre symptôme associé est rarement révélatrice d’un cancer 19.
Délais de consultation : L’étude allemande sur 287 femmes a révélé un délai médian de consultation de 16 jours après l’apparition des premiers symptômes, avec 18% des patientes attendant plus de 3 mois 20. Les délais prolongés (>3 mois) sont associés à des stades plus avancés, particulièrement pour les tumeurs peu différenciées 20.
Symptômes systémiques : Les formes avancées peuvent s’accompagner de symptômes généraux incluant fatigue (0,3% des présentations), perte de poids (0,3%), ou douleurs osseuses, suggérant une extension métastatique 1. L’œdème du membre supérieur (0,2% des cas) peut révéler une atteinte ganglionnaire extensive 1.
Références:
1 Koo MM, et al. Typical and atypical presenting symptoms of breast cancer and their associations with diagnostic intervals. PMC. 2017.
2 National Breast Cancer Foundation. Clinical Breast Exam. 2025.
3 Radiopaedia. Benign and malignant characteristics of breast lesions at ultrasound. 2024.
4 Elmore JG, et al. Specificity of Clinical Breast Examination in Community Practice. PMC. 2007.
5 American Cancer Society. Breast Cancer Signs and Symptoms. 2021.
6 Bosch AM, et al. Estimation of tumor size in breast cancer comparing clinical examination, mammography, ultrasound and MRI-correlation with pathological examination of the surgical specimen. PMC. 2006.
7 CDC. Symptoms of Breast Cancer. 2024.
8 American Cancer Society. Inflammatory Breast Cancer | Details, Diagnosis, and Signs. 2021.
9 HealthCentral. Peau D’Orange: Breast Cancer and Other Causes. 2024.
11 Bass Cancer Center. Breast Cancer Skin Changes: What to Watch For. 2025.
12 Medical News Today. Breast cancer dimpling: Causes and treatment. 2024.
13 Mayo Clinic. Breast cancer – Symptoms and causes. 2025.
14 Wikidoc. Breast cancer physical examination. 2013.
15 Cancer Research UK. Symptoms of breast cancer. 2024.
16 Morrogh M, et al. Nipple Discharge: A Sign of Breast Cancer? PMC. 2007.
17 Chen L, et al. Bloody nipple discharge is a predictor of breast cancer risk. PubMed. 2012.
18 Vargas HI, et al. Nipple discharge: is its significance as a risk factor for breast cancer fully understood? PubMed. 2010.
19 WebMD. Breast Cancer Symptoms and Early Warning Signs. 2024.
20 Arndt V, et al. Patient delay and stage of diagnosis among breast cancer patients in Germany. PMC. 2002.
Le Dépistage et la Prévention
Auto-palpation : comment et quand ?
L’auto-examen des seins (AES) constitue une méthode simple et accessible de détection précoce, bien que son efficacité reste controversée selon les données scientifiques récentes 1. Une méta-analyse majeure portant sur 20 études observationnelles et trois essais cliniques a révélé que l’AES ne réduit pas significativement la mortalité par cancer du sein dans les essais contrôlés randomisés (risque relatif poolé : 1,01, IC 95% : 0,92-1,12) 1. Cependant, cette même analyse montre une réduction de 36% du risque de décès chez les femmes diagnostiquées qui pratiquaient l’AES avant le diagnostic (risque relatif 0,64, IC 95% : 0,56-0,73), bien que ces résultats soient probablement influencés par des biais de sélection 1.
Malgré ces limitations, l’AES présente des avantages pratiques importants 2. Il s’agit d’une méthode non invasive, gratuite, ne nécessitant aucun équipement spécialisé et permettant un diagnostic préliminaire en 5 minutes 2. Une étude récente menée auprès de professionnelles de santé a montré que 96% des cancers du sein étaient initialement détectés par les patientes elles-mêmes, tandis qu’un seul cas sur 26 était identifié lors d’un examen clinique par un médecin 3.
Technique et fréquence recommandées : L’AES doit être pratiqué mensuellement, idéalement 5-7 jours après les règles chez les femmes pré-ménopausées, ou à date fixe chez les femmes ménopausées 2. La technique comprend une inspection visuelle devant un miroir (bras le long du corps puis levés) et une palpation systématique avec la pulpe des trois doigts médians en effectuant des mouvements circulaires de pression croissante 2. L’examen doit couvrir l’ensemble du sein depuis la clavicule jusqu’au sillon sous-mammaire et de l’aisselle jusqu’au sternum 2.
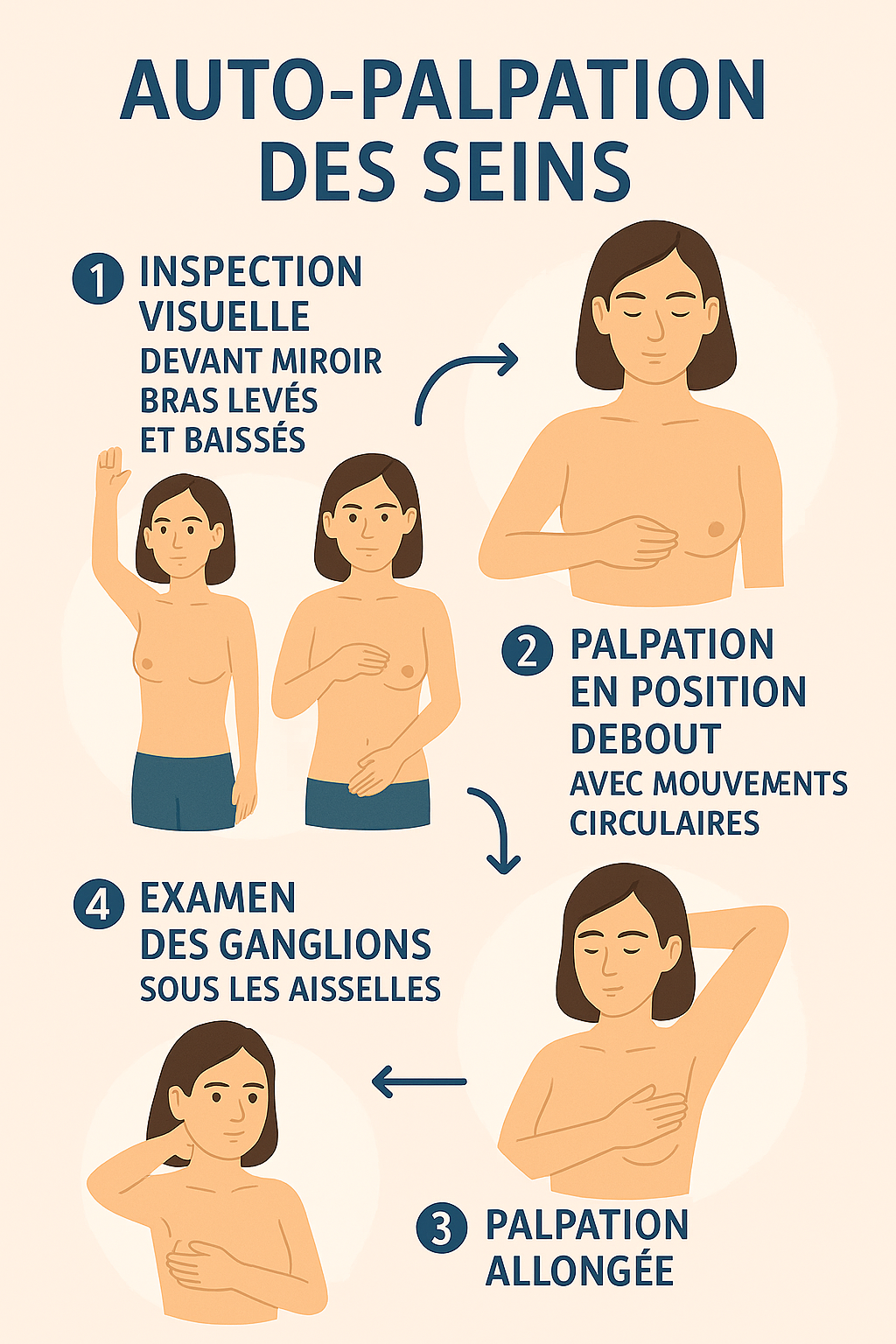
Technique d’auto-examen des seins en 4 étapes. credit: Association PATH
Facteurs associés à la pratique : Les études montrent que l’âge, le niveau de revenu et les connaissances sur l’AES constituent les principaux déterminants de sa pratique 2. Les femmes plus âgées et celles disposant de meilleures connaissances sur la technique présentent des taux de pratique significativement plus élevés 2. Le manque de confiance dans la capacité d’application correcte de la technique et la peur de découvrir une anomalie constituent les principales barrières à la pratique 2.

credit: Association PATH
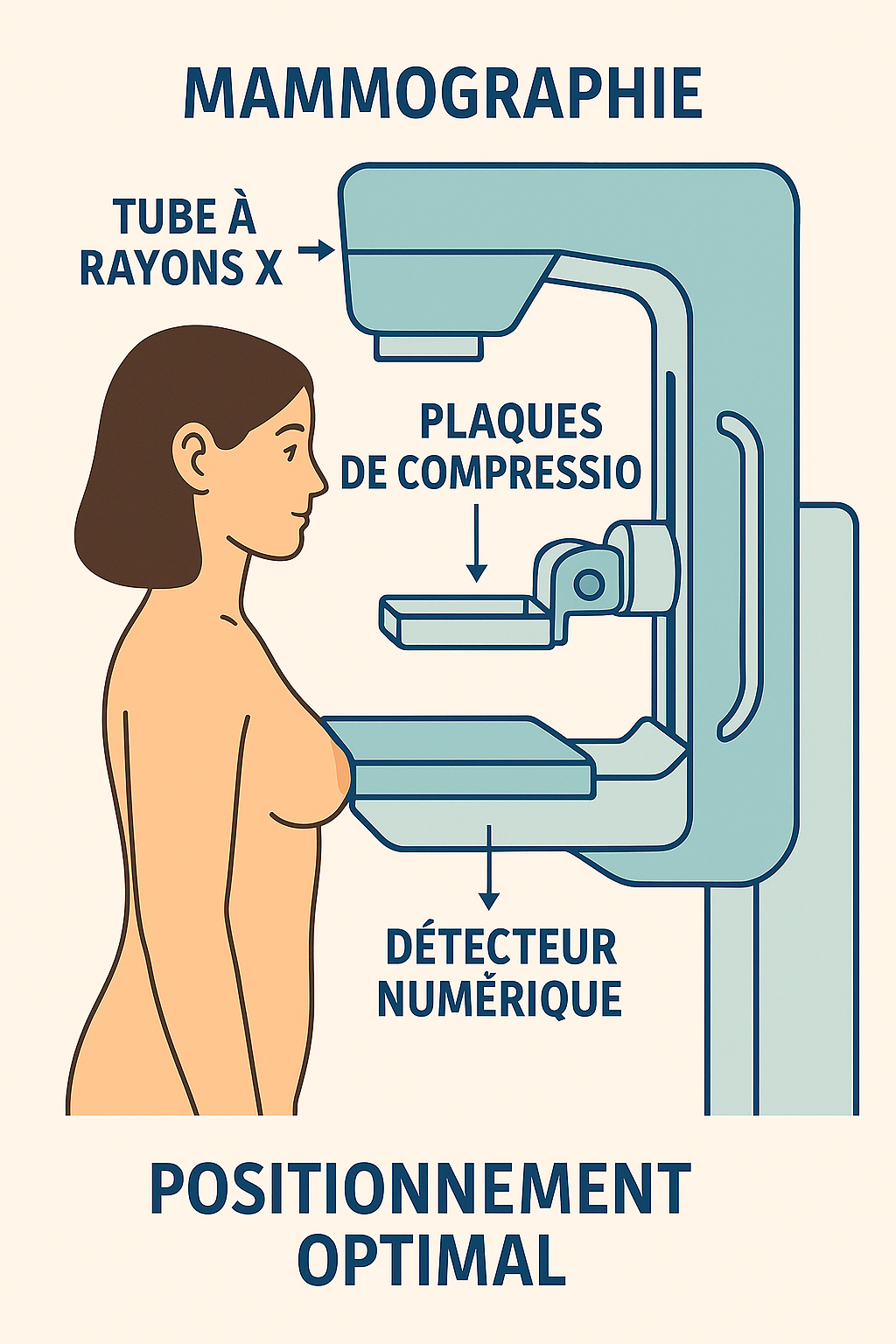
Mammographie : à partir de quel âge ?
La mammographie constitue l’examen de référence pour le dépistage du cancer du sein, avec des recommandations récemment actualisées 4. En avril 2024, l’United States Preventive Services Task Force (USPSTF) a abaissé l’âge de début du dépistage à 40 ans, recommandant une mammographie biennale pour toutes les femmes de 40 à 74 ans 5. Cette révision fait suite à l’augmentation de l’incidence du cancer du sein chez les femmes de 40-49 ans, avec une progression annuelle de 2% entre 2015 et 2019 6.
Système français de dépistage organisé : En France, le programme national de dépistage organisé cible les femmes de 50 à 74 ans sans symptômes ni facteurs de risque particuliers 7, 8, 9. Ce programme propose une mammographie tous les deux ans, complétée par un examen clinique des seins, avec double lecture systématique de chaque mammographie normale en première lecture 9. Depuis janvier 2024, les invitations sont dématérialisées et déposées dans le compte ameli, avec prise en charge à 100% par l’Assurance Maladie 7.
Performance diagnostique : Les méta-analyses récentes démontrent une sensibilité poolée de la mammographie de 78-82% et une spécificité de 78-84% pour la détection du cancer du sein 10, 11. Ces performances varient selon la densité mammaire, avec une sensibilité réduite chez les femmes présentant des seins denses 10. L’efficacité du dépistage mammographique est particulièrement démontrée chez les femmes de 60-69 ans, avec une réduction de mortalité de 33% et prévention de 21,3 décès pour 10 000 femmes sur 10 ans 5.
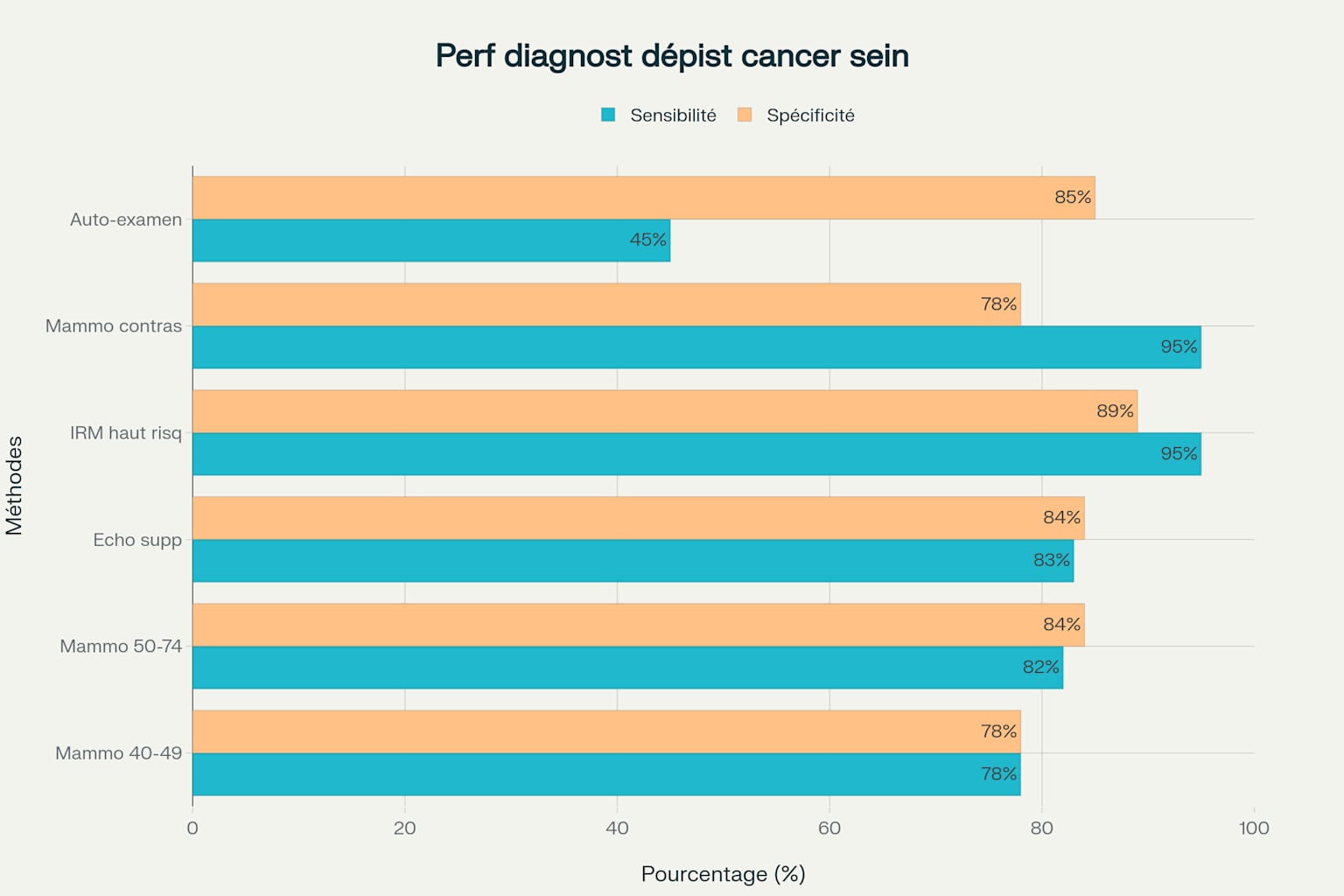
Performance diagnostique des différentes méthodes de dépistage du cancer du sein selon l’âge et le niveau de risque
Taux de participation : Malgré l’excellence de l’organisation française, le taux de participation reste préoccupant avec 48,2% des femmes éligibles en 2023 9. Cette participation insuffisante constitue un enjeu majeur de santé publique, l’objectif européen étant fixé à 70% 9. Les disparités régionales sont marquées, la Bourgogne-Franche-Comté et la Normandie présentant les meilleurs taux, tandis que la Guyane et la Corse affichent les plus faibles 9.
Examens complémentaires (IRM, échographie)
Échographie mammaire : L’échographie constitue un complément précieux à la mammographie, particulièrement chez les femmes jeunes et celles présentant des seins denses 10. Les méta-analyses montrent une sensibilité de 83-94% et une spécificité de 84% pour l’échographie 10. Sur une base per-lésion, l’échographie présente une précision diagnostique supérieure à la mammographie avec une sensibilité de 94% versus 76% 10. Cependant, l’ajout systématique de l’échographie au dépistage mammographique augmente significativement les taux de faux positifs et de biopsies sans amélioration démontrée du taux de détection des cancers 12.
IRM mammaire : L’IRM constitue l’examen de choix pour la surveillance des femmes à haut risque génétique 13. Une étude britannique portant sur 477 IRM de dépistage chez 184 femmes à haut risque a démontré un taux de détection du cancer de 2,1% et un taux de rappel de 9,2%, conformes aux standards nationaux 13. L’IRM mammaire présente une sensibilité significativement supérieure à la mammographie pour la détection du cancer chez les femmes à haut risque 14. Les femmes avec un risque cumulé de cancer du sein ≥20% bénéficient d’un dépistage annuel par IRM dès l’âge de 30 ans 14.
Mammographie avec produit de contraste (CESM) : La mammographie rehaussée par contraste émerge comme technique innovante avec des performances diagnostiques élevées 15, 16. Une méta-analyse récente de 60 études incluant 11 049 examens a démontré une sensibilité poolée de 97% et une spécificité de 76% 16. La CESM présente des performances particulièrement intéressantes chez les femmes avec seins denses (sensibilité 95%, spécificité 78%) et pour l’évaluation de lésions suspectes détectées en mammographie (sensibilité 92%, spécificité 84%) 16.
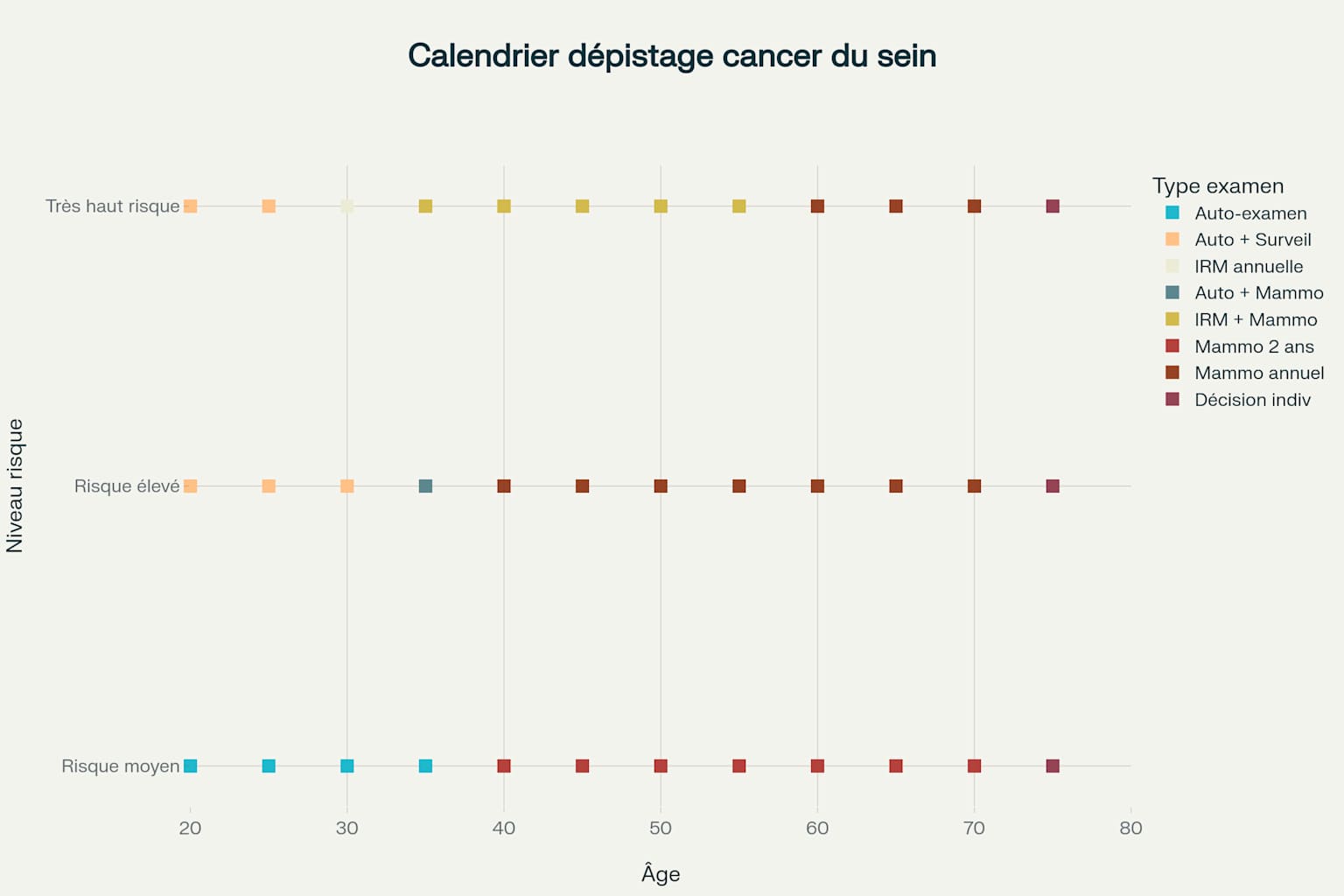
Calendrier personnalisé de dépistage du cancer du sein selon l’âge et le niveau de risque individuel
Prévention primaire et secondaire
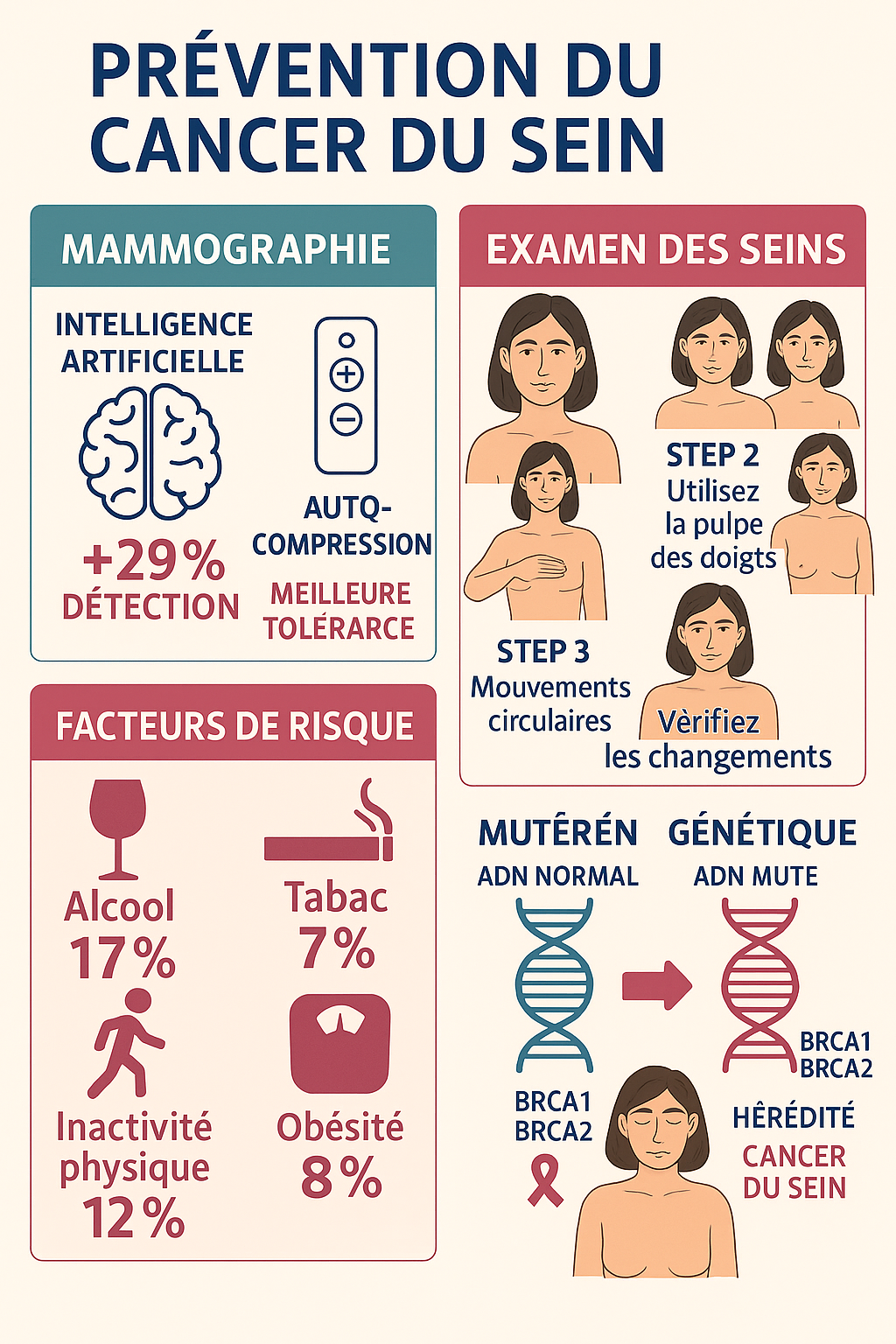
Infographie complète sur la prévention primaire et secondaire du cancer du sein
Prévention primaire : Les interventions de style de vie constituent la stratégie la plus efficace et coût-efficace pour la prévention primaire du cancer du sein 17, 18. Les recommandations de l’American Institute for Cancer Research incluent le maintien d’un poids normal, l’adoption d’une alimentation pauvre en graisses et riche en végétaux, la pratique d’une activité physique régulière, et l’évitement de l’alcool 17.
L’activité physique présente un effet protecteur bien documenté, avec une réduction du risque de 20% chez les femmes pratiquant plus de 30 minutes d’exercice quotidien 19, 20. Une méta-analyse de 18 études observationnelles a montré que l’adhésion à un régime alimentaire prudent réduit le risque de cancer du sein de 11% 21. L’essai PREDIMED a démontré une réduction de 68% du risque de cancer du sein avec un régime méditerranéen supplémenté en huile d’olive extra-vierge (HR 0,32, IC 95% : 0,13-0,79) 21.
Chimioprévention : Chez les femmes à haut risque, la chimioprévention peut réduire significativement l’incidence du cancer du sein 22. L’ablation chirurgicale préventive des seins réduit le risque de 90-95%, tandis que la salpingo-ovariectomie bilatérale permet une réduction d’environ 50% 22. L’hormonothérapie préventive par tamoxifène ou inhibiteurs de l’aromatase constitue également une option pour les femmes à très haut risque 22.
Prévention secondaire : Le dépistage organisé représente la pierre angulaire de la prévention secondaire 23. L’amélioration du taux de participation constitue l’enjeu principal, avec des stratégies incluant l’utilisation du numérique, l’adaptation territoriale des campagnes d’information, et l’intégration progressive de l’intelligence artificielle pour améliorer la performance diagnostique 9. La prévention secondaire implique l’utilisation d’examens pour détecter un cancer avant l’apparition de signes ou symptômes, avec pour objectif de réduire l’incidence et/ou la mortalité 23.
Références
1 PMC. Breast self-examination and death from breast cancer: a meta-analysis. 2003.
2 PMC. Pratique de l’auto-examen des seins et facteurs associés chez les professionnelles de la santé. 2024.
3 PMC. The Efficacy of Clinical Breast Exams and Breast Self-Exams in Evaluating Palpable Breast Masses. 2022.
4 Breast Cancer.org. Mammogram Screening Guidelines 2025. 2025.
5 USPSTF. Summary of USPSTF Final Recommendation: Screening for Breast Cancer. 2024.
6 ACOG. ACOG Updates Recommendation on When to Begin Breast Cancer Screening Mammography. 2025.
7 Ameli.fr. Le dépistage organisé du cancer du sein. 2025.
8 Ameli.fr. Dépistage organisé du cancer du sein pour les femmes entre 50 et 74 ans. 2025.
9 Santé publique France. Participation au programme de dépistage organisé du cancer du sein en 2024. 2025.
10 PubMed. Diagnostic performance of mammography and ultrasound in breast cancer. 2023.
11 Oncology and Radiotherapy. Sensitivity and specificity of ultrasound and mammography. 2023.
12 JAMA Internal Medicine. Screening Ultrasonography as Adjunct to Screening Mammography. 2019.
13 PMC. Breast screening with MRI in high-risk women. 2014.
14 ACR. Provider Breast Cancer Risk Assessment Handout. 2024.
15 PMC. Meta-analysis and systematic review of the diagnostic value of CESM. 2024.
16 Radiology. Contrast-enhanced Mammography: A Systematic Review and Meta-Analysis. 2021.
17 PubMed. Lifestyle for breast cancer risk reduction. 2022.
18 PubMed. Lifestyle components and primary breast cancer prevention. 2014.
19 Europa Donna. Primary prevention and breast health. 2024.
20 National Breast Cancer Foundation. Healthy Habits. 2025.
21 PMC. Lifestyle Interventions for Breast Cancer Prevention. 2018.
22 CBIP. Prévention primaire du cancer du sein. 2024.
23 WHO. Secondary prevention of cancer: an overview. 1986.
24 CDC. Update to Breast Cancer Screening Guidelines – WTCHP. 2024.
25 PubMed. Trial of early detection of breast cancer: description of method. 1982.
26 Radiology. A Systematic Review and Meta-Analysis of Diagnostic Performance. 2021.
27 Mayo Clinic. Breast Cancer Screening Guidelines Revised. 2018.
28 Cancer.fr. Cancers du sein : les prévenir et les détecter tôt. 2024.
29 ARS Grand Est. Dépistages organisés des cancers. 2024.
30 Vermont Breast Cancer Surveillance System. Identifying effective risk-based supplemental ultrasound screening strategies. 2024.
31 PAHO. Breast Cancer Risk Factors and Prevention. 2020.
Diagnostic
Étapes du diagnostic : consultation, biopsie, examens d’imagerie
Le diagnostic du cancer du sein constitue un processus structuré qui débute par un examen clinique approfondi suivi d’examens d’imagerie appropriés et se confirme par une analyse histopathologique 1. L’examen clinique mammaire présente une spécificité remarquable de 99,4% chez les femmes à risque moyen, bien que sa sensibilité reste limitée pour les petites lésions non palpables 2.
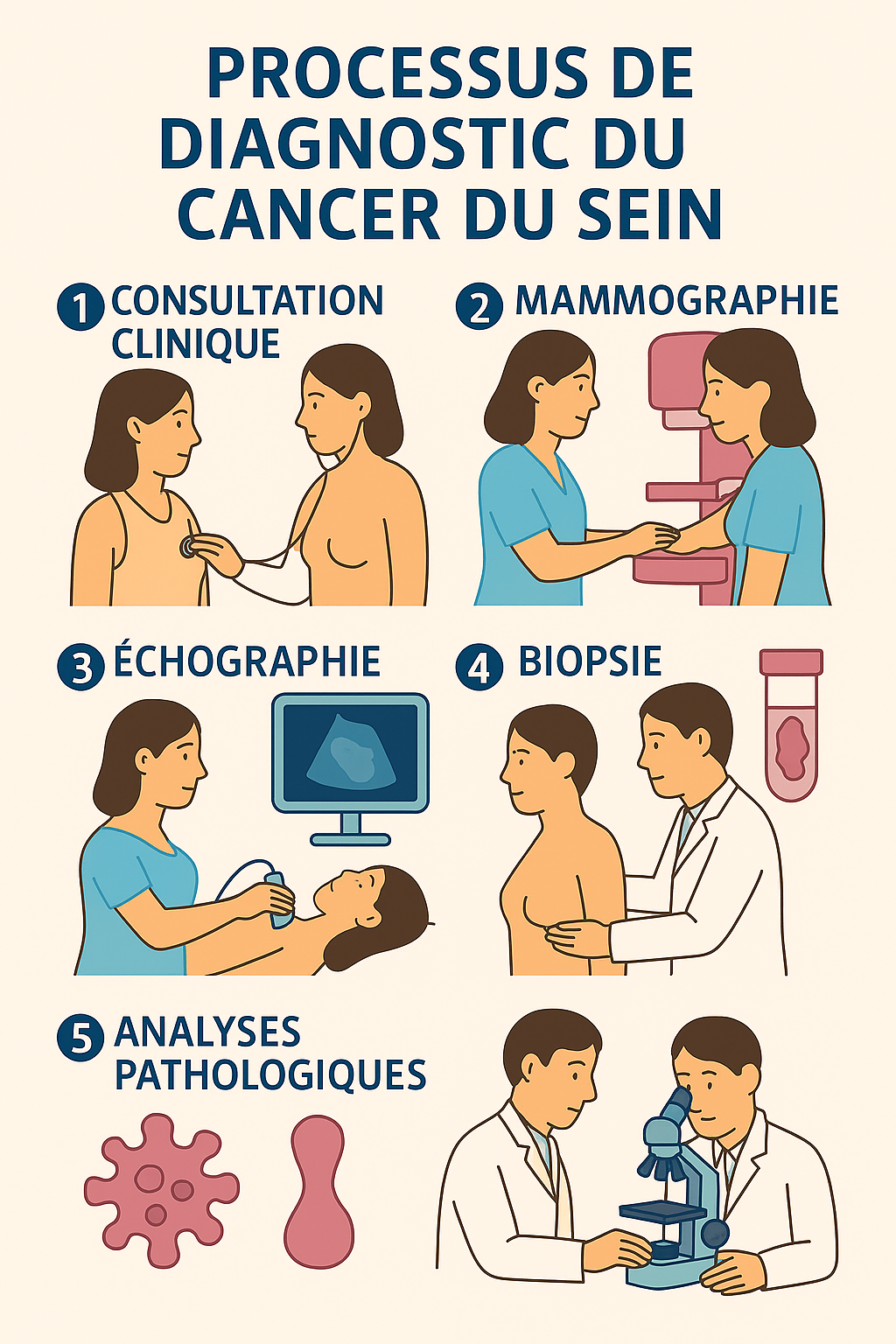
Processus de diagnostic du cancer du sein en 5 étapes principales
La mammographie diagnostique représente l’examen de référence avec une sensibilité de 78-82% et une spécificité de 78-84% pour la détection du cancer du sein 3. L’échographie mammaire complète souvent l’évaluation, particulièrement efficace chez les femmes jeunes avec des seins denses, affichant une sensibilité de 83-94% 4. L’IRM mammaire constitue l’examen le plus sensible, réservé aux cas complexes et à la surveillance des femmes à haut risque génétique 5.

Mammography images illustrating different breast density classifications, their corresponding sensitivity, and age distributionwikipedia
Le système BI-RADS (Breast Imaging Reporting and Data System) standardise l’interprétation des examens d’imagerie mammaire selon sept catégories, de BI-RADS 0 (examen incomplet) à BI-RADS 6 (cancer prouvé) 6. BI-RADS 4 indique une suspicion avec subdivision en 4A (2-9% de probabilité), 4B (10-49%), et 4C (50-94%), tandis que BI-RADS 5 signale une forte suspicion (>95%) 7.
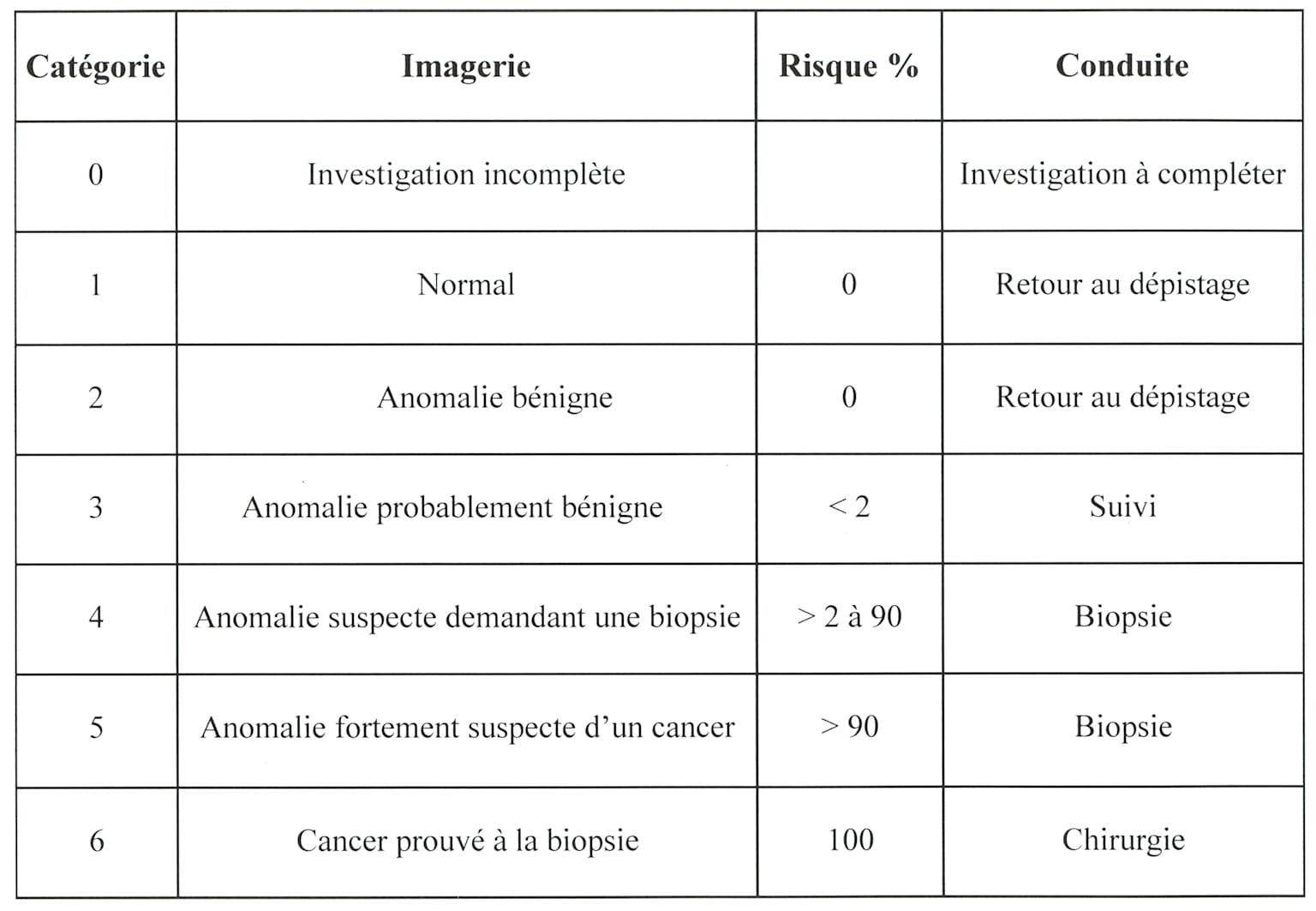
BI-RADS classification table detailing breast imaging findings, associated cancer risk, and recommended clinical management depistagesein
Techniques de biopsie et précision diagnostique
La biopsie percutanée par macro-biopsie constitue la méthode de référence pour la confirmation histologique, avec un taux d’accord de 96% selon une large étude portant sur 2 420 lésions 8. Cette technique utilise une aiguille de calibre 14G sous guidage échographique, permettant d’obtenir des échantillons tissulaires suffisants pour l’analyse histologique et immunohistochimique 9.

Comparaison des techniques de biopsie mammaire
Les dispositifs de biopsie assistée par le vide permettent d’obtenir des échantillons tissulaires plus volumineux en un seul passage, réduisant potentiellement les faux négatifs 10. Le diagnostic de carcinome canalaire in situ (CCIS) par biopsie percutanée présente des défis particuliers, avec seulement 65% de diagnostic correct à la biopsie initiale comparé à 92% pour les cancers invasifs 11.
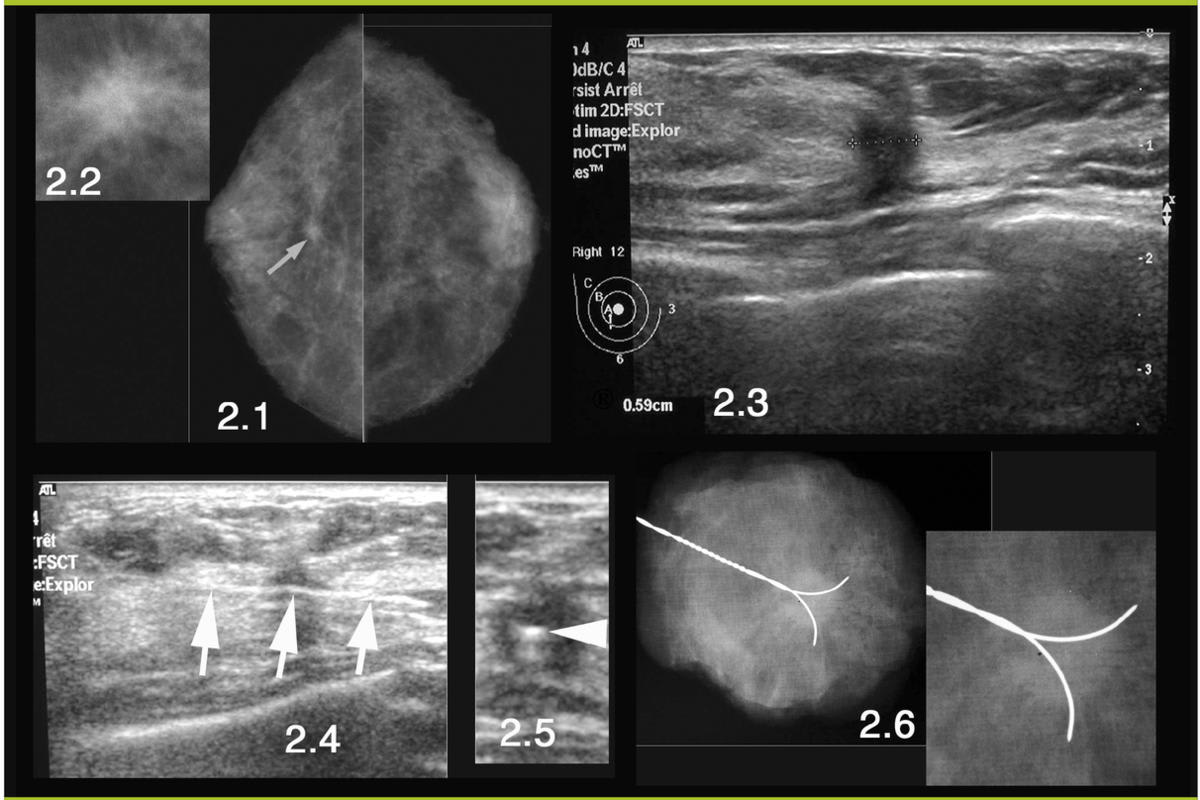
Medical imaging techniques, including mammography and ultrasound, used for guided breast biopsy and localization procedures revmed
Interprétation des résultats
La classification histologique suit les critères de l’Organisation Mondiale de la Santé, distinguant principalement les carcinomes canalaires (80% des cas) des carcinomes lobulaires (10-15%) 12. Le grade histologique selon le système de Nottingham constitue un facteur pronostique indépendant évalué selon trois critères : formation tubulaire, pléomorphisme nucléaire et activité mitotique 13.
L’évaluation morphologique des lymphocytes infiltrant la tumeur (TILs) constitue un biomarqueur émergent, chaque augmentation de 10% des lymphocytes stromaux étant associée à une réduction de 16% du risque de décès dans les cancers triple-négatifs 14.
Classification du cancer (stades, grades, récepteurs hormonaux, HER2…)
La classification TNM évalue la taille tumorale (T), l’atteinte ganglionnaire (N) et les métastases (M), avec une stadification pronostique intégrant TNM, grade, et statut des biomarqueurs ER, PR, HER2 15.
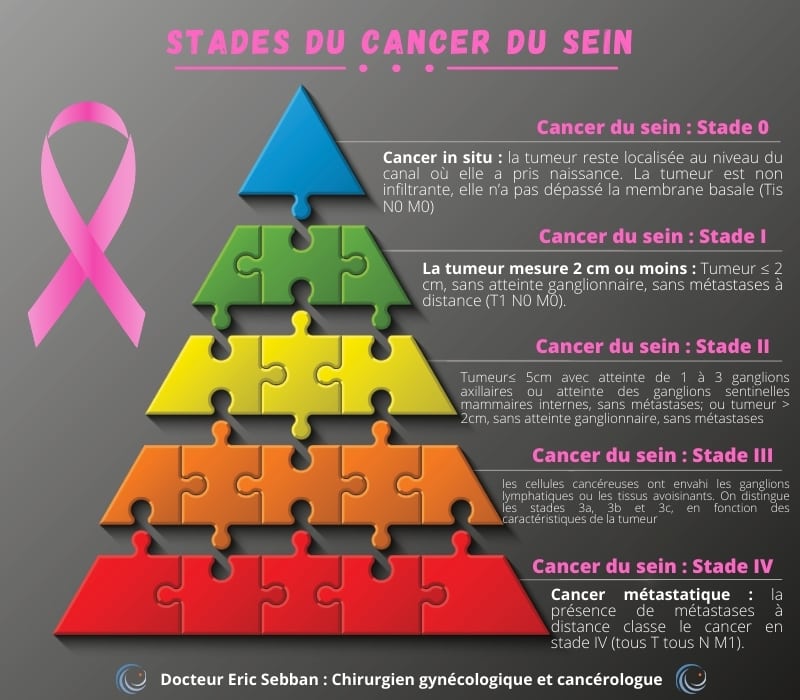
An illustration detailing the five stages of breast cancer, from in situ (Stade 0) to metastatic (Stade IV), with corresponding descriptions docteur-eric-sebban
La classification moléculaire contemporaine reconnaît plusieurs sous-types basés sur l’expression des récepteurs hormonaux et HER2 : Luminal A (ER≥1%, PR≥20%, Ki-67<20%, HER2-négatif), Luminal B, HER2-enrichi, et triple-négatif 14. Le sous-type HER2-faible, défini par une expression faible de HER2 (IHC 1+ ou 2+ avec ISH négatif), constitue une entité thérapeutique distincte représentant environ 45-55% des cancers du sein 11.
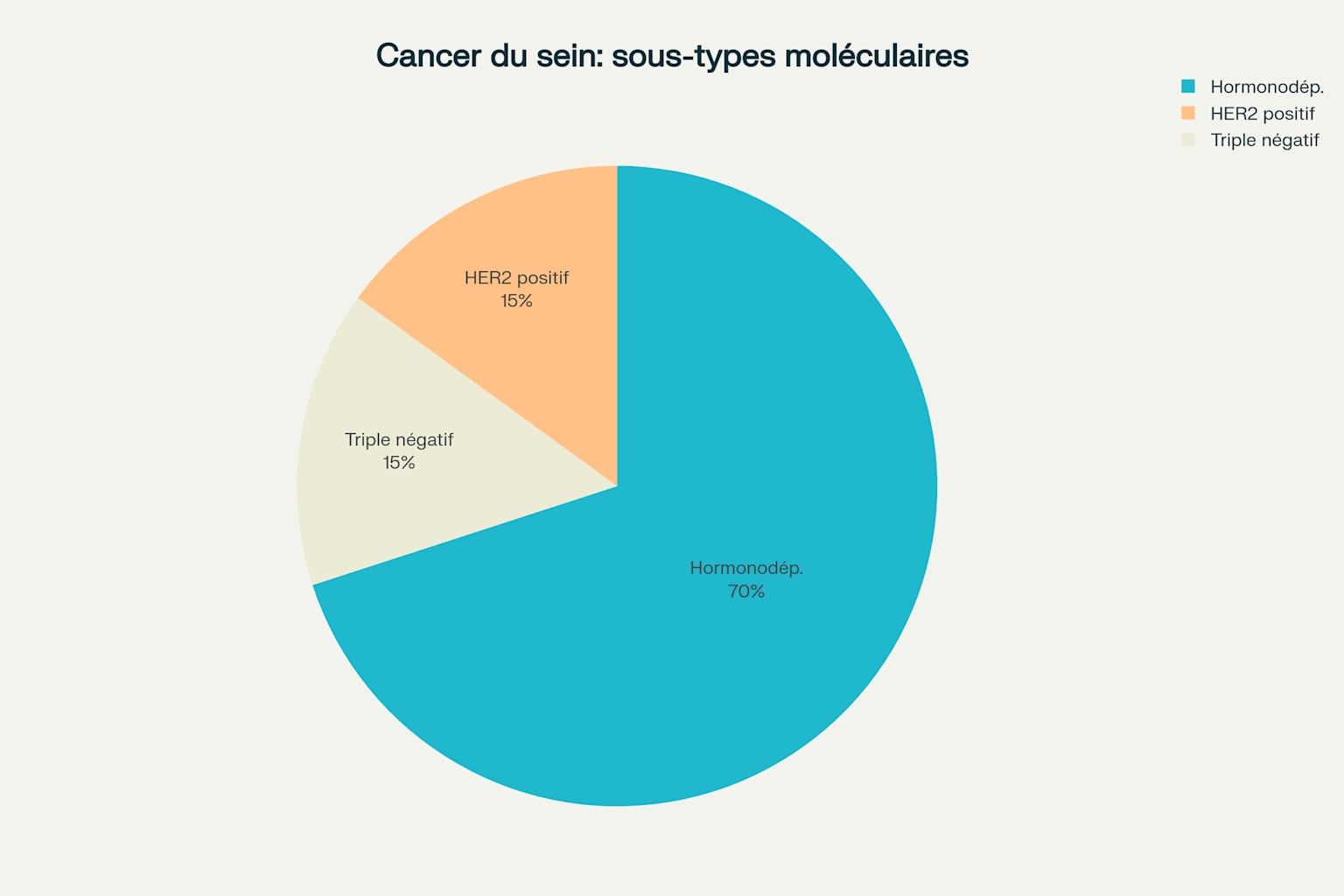
Classification moléculaire des cancers du sein
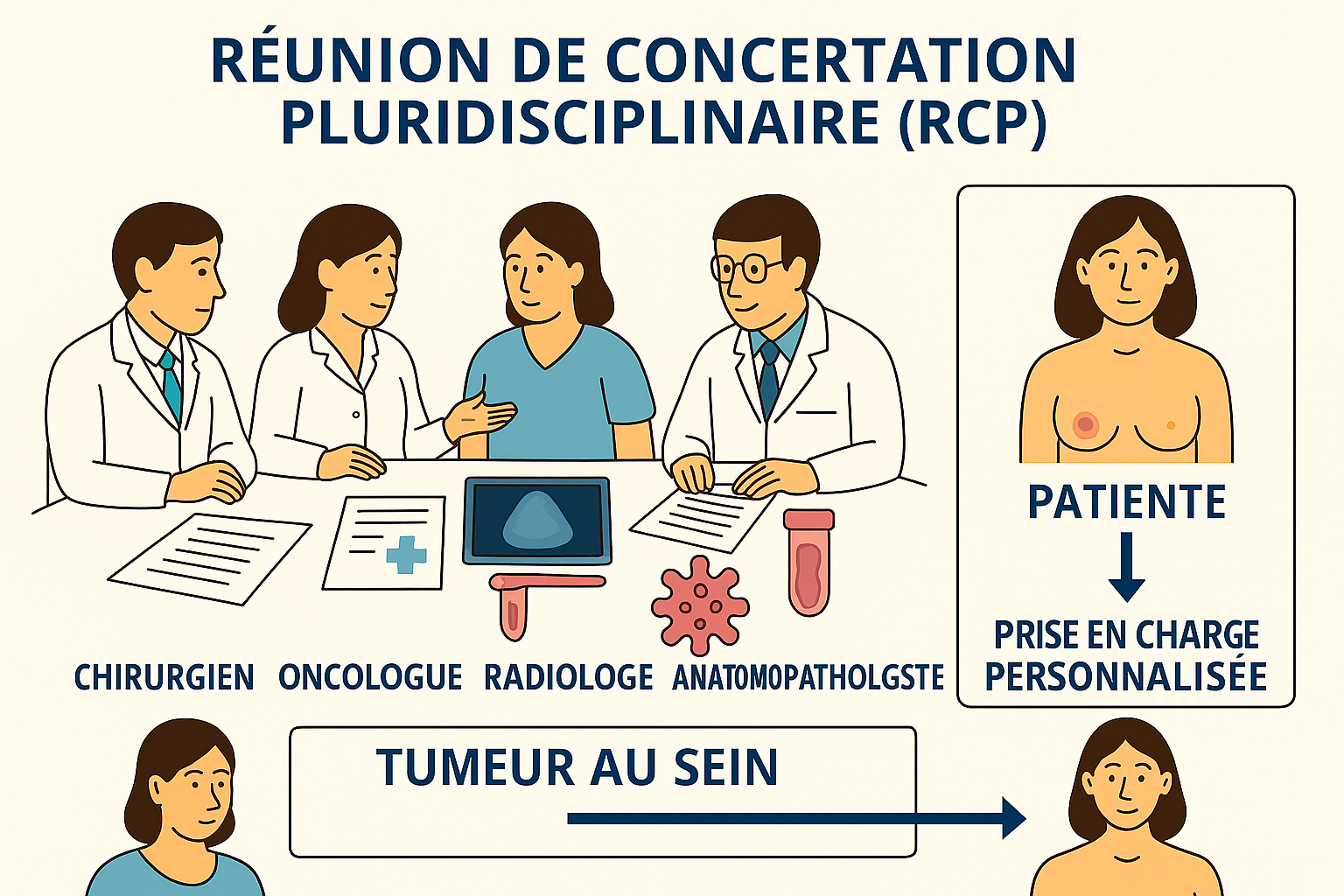
Rôle de l’équipe multidisciplinaire dans le diagnostic
L’approche diagnostique moderne repose sur une coordination multidisciplinaire impliquant chirurgiens spécialisés en sénologie, oncologues médicaux, radiothérapeutes, radiologues, anatomopathologistes, et infirmières spécialisées 3. Les Réunions de Concertation Pluridisciplinaire (RCP) constituent le socle de la prise en charge moderne, permettant l’élaboration d’une stratégie thérapeutique personnalisée basée sur l’ensemble des données diagnostiques 5.
Évolutions récentes et innovations diagnostiques
L’intelligence artificielle révolutionne l’analyse anatomopathologique avec des algorithmes capables d’améliorer la reproductibilité du grading histologique et d’automatiser la gradation des carcinomes mammaires 16. Les études récentes montrent qu’une approche d’apprentissage profond peut détecter 76% des cancers d’intervalle, renforçant le rôle de l’IA comme outil d’aide à la décision radiologique 17.

Rôle de l’intelligence artificielle dans le diagnostic du cancer du sein
Les panels multigéniques comme Oncotype DX et MammaPrint permettent d’évaluer le risque de récidive et la nécessité d’une chimiothérapie, représentant une évolution majeure vers la médecine personnalisée 18. L’analyse de l’ADN tumoral circulant (ctDNA) émerge comme biomarqueur pour évaluer la réponse thérapeutique et détecter précocement les récidives 19.
Cette évolution diagnostique vers une approche intégrée, combinant imagerie de pointe, analyse histopathologique raffinée, et caractérisation moléculaire approfondie, constitue le fondement de la médecine personnalisée moderne en oncologie mammaire 20.
Les Types de Cancers du Sein
Carcinome canalaire in situ (CCIS)
Le carcinome canalaire in situ représente la forme la plus courante de cancer du sein non infiltrant, constituant huit à neuf cancers in situ sur dix 1. Le CCIS se caractérise par la présence de cellules cancéreuses confinées aux canaux galactophores sans franchissement de la membrane basale 2. Ces cellules anormales restent localisées dans le revêtement du canal mammaire et ne se sont pas propagées aux tissus mammaires voisins ou à d’autres organes 2.
Le CCIS présente une excellente capacité de guérison lorsqu’il est détecté précocement, avec un taux de survie proche de 100% 3. Cependant, cette forme nécessite un traitement approprié car elle peut évoluer vers un carcinome invasif en l’absence de prise en charge 2. La classification du CCIS repose sur trois grades distincts : bas, intermédiaire et haut, reflétant l’apparence des cellules et leur vitesse de développement comparativement aux cellules normales 2.
Classification histologique du CCIS : Le CCIS de type comédocarcinome se caractérise par des cellules dont le centre semble obstrué de tissus morts, correspondant à un grade élevé avec une croissance cellulaire rapide et un risque accru de récidive 2. À l’inverse, le CCIS de type non comédocarcinome présente un grade bas ou intermédiaire, évoluant lentement avec une probabilité moindre de progression vers un cancer invasif 2.
La détection du CCIS s’effectue principalement par mammographie de dépistage, car cette forme reste généralement non palpable 2. Les microcalcifications constituent souvent le seul signe radiologique révélateur de cette forme précoce de cancer 3.
Carcinome lobulaire
Le carcinome lobulaire prend naissance dans les cellules des lobules mammaires, représentant environ 10% des tumeurs mammaires infiltrantes 4. Cette forme se subdivise en deux catégories principales : le carcinome lobulaire in situ (CLIS) et le carcinome lobulaire infiltrant (CLI) 4, 3.
Carcinome lobulaire in situ : Le CLIS se caractérise par une accumulation de cellules anormales confinées aux lobules mammaires 3. Contrairement au CCIS, le CLIS est souvent considéré comme un marqueur de risque accru plutôt qu’un véritable cancer, justifiant une surveillance renforcée 3.
Carcinome lobulaire infiltrant : Le CLI représente 10-15% des cancers du sein infiltrants et présente des caractéristiques biologiques particulières 4. Les cellules tumorales s’organisent en “bandes” au niveau des tissus graisseux du sein, ne formant pas nécessairement de masse palpable 4. Cette particularité peut rendre la détection clinique et radiologique plus difficile que pour les carcinomes canalaires 4.
Le CLI peut se manifester dans différentes zones de la glande mammaire simultanément et présente une tendance à l’atteinte bilatérale 4. Les modifications cutanées peuvent inclure un changement de texture et un aspect “peau d’orange”, bien que la masse palpable ne soit pas toujours présente 4.
Cancer du sein triple négatif
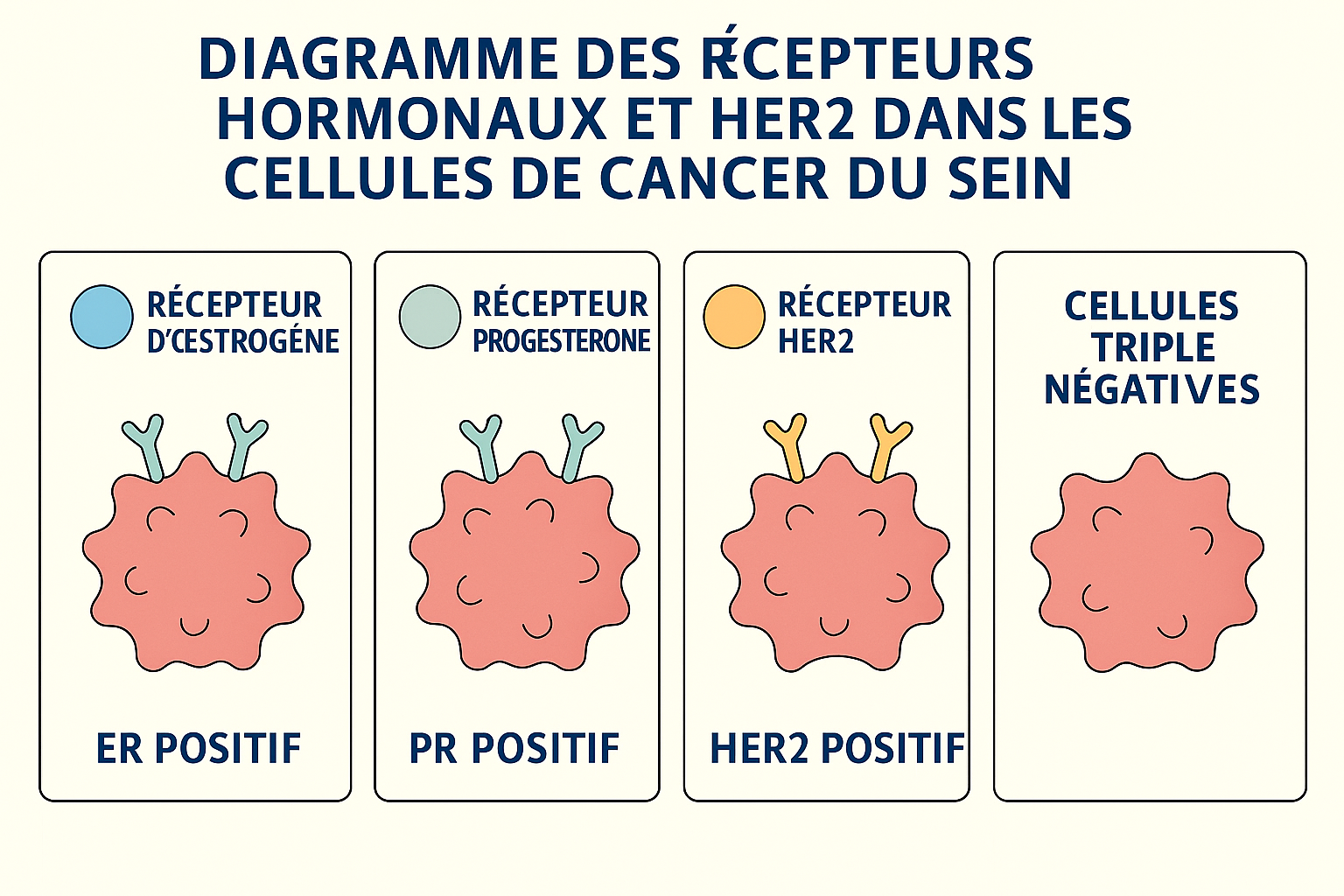
Le cancer du sein triple négatif (CSTN) constitue un sous-type distinct caractérisé par l’absence de trois récepteurs spécifiques : récepteurs aux œstrogènes (RE-), récepteurs à la progestérone (RP-), et absence de surexpression du récepteur HER2 (HER2-) 5, 6. Cette forme représente environ 15% des cancers du sein chez les femmes et 5% chez les hommes 5.
Caractéristiques épidémiologiques : Le CSTN touche plus de 9 000 femmes chaque année en France, avec une prédominance chez les femmes jeunes : 40% des patientes ont moins de 40 ans au moment du diagnostic 7. Cette répartition diffère significativement des autres types de cancers du sein qui affectent préférentiellement les femmes de plus de 50 ans 8.
Profil biologique et pronostic : Le CSTN se distingue par son caractère agressif et sa progression rapide, nécessitant un diagnostic et une prise en charge précoces 7. Le taux de mortalité atteint 40% dans les cinq années suivant le diagnostic, avec une durée médiane de survie après métastase de seulement 13 mois 9. Le taux de récidive après chirurgie s’élève à 25%, avec un délai moyen de rechute de 19 à 40 mois comparé à 35-67 mois pour les cancers non triple négatifs 9.
Défis thérapeutiques : L’absence des trois récepteurs exclut plusieurs options thérapeutiques ciblées, notamment l’hormonothérapie et les inhibiteurs de HER2 6. La chimiothérapie constitue le principal traitement systémique, bien que l’efficacité de la chimioradiothérapie adjuvante postopératoire conventionnelle reste médiocre 9. Récemment, l’immunothérapie a émergé comme une approche prometteuse, avec le pembrolizumab démontrant des résultats encourageants dans cette indication 7.
Cancer du sein HER2 positif
Le cancer du sein HER2 positif se caractérise par la surexpression du récepteur 2 du facteur de croissance épidermique humain (HER2) dans les cellules cancéreuses 10, 11. Cette forme touche environ 15 à 20% de toutes les patientes atteintes d’un cancer du sein et était historiquement associée à un pronostic défavorable avant l’avènement des thérapies ciblées 11.
Révolution thérapeutique : L’introduction des anticorps anti-HER2, notamment le trastuzumab (Herceptine®), a révolutionné la prise en charge de ces tumeurs auparavant de mauvais pronostic 12. Les résultats de l’association trastuzumab + deruxtecan dans le cancer du sein HER2 positif métastatique montrent une amélioration spectaculaire de la survie sans progression : 75,8% des patientes traitées après un an contre 34,1% avec le traitement habituel précédent 10.
Innovations récentes : L’étude PHERGain représente une avancée majeure dans la personnalisation thérapeutique des cancers HER2 positifs 11. Cette étude de conception stratégique adaptative explore la possibilité de réduire ou d’éliminer la chimiothérapie dans un sous-groupe de patientes atteintes d’un cancer du sein HER2+ à un stade précoce 11. L’approche consiste à moduler le traitement en fonction de la réponse thérapeutique individuelle de chaque patiente 11.
Le traitement conventionnel combine chimiothérapie et double blocage de HER2, mais les innovations permettent désormais d’envisager des stratégies de désescalade thérapeutique pour réduire les effets secondaires tout en maintenant l’efficacité oncologique 11.
Cancer inflammatoire du sein

Cette forme rare et particulièrement agressive représente 1 à 5% de tous les cancers du sein 13, 14. Le cancer inflammatoire se caractérise par une induration cutanée diffuse d’aspect charnu, habituellement sans tumeur palpable sous-jacente 13. Les cellules cancéreuses bloquent les vaisseaux lymphatiques de la peau, provoquant rougeur, œdème et aspect inflammatoire du sein 13.
Cette forme touche plus volontiers les femmes jeunes et d’origine africaine, avec une évolution particulièrement rapide et une tendance à la propagation métastatique 13. Le diagnostic est souvent retardé par confusion avec une mastite, ce qui complique la prise en charge et assombrit le pronostic 13. Les symptômes incluent un gonflement rapide d’un sein, des changements de couleur de la peau (rouge, rose ou violacée), un épaississement cutané avec aspect “peau d’orange”, et des modifications cutanées diverses 14.
Maladie de Paget du sein
La maladie de Paget constitue une forme atypique rare représentant 1 à 4% des cancers du sein diagnostiqués 15, 16. Elle se manifeste par une ulcération du mamelon habituellement unilatérale, résultant de l’envahissement de l’épiderme par des cellules cancéreuses issues d’un adénocarcinome canalaire sous-jacent 17, 18.
Cette pathologie affecte principalement les femmes de plus de 50 ans, avec un âge au diagnostic variant entre 51 et 70 ans 15, 17. Les symptômes caractéristiques incluent rougeur, desquamation, démangeaisons, douleurs ou sensation de brûlure au niveau du mamelon et de l’aréole, souvent accompagnés d’un écoulement mamelonnaire 15, 19. Dans 80% des cas, la maladie de Paget est associée à un cancer du sein sous-jacent 17.
Le premier signe clinique est l’aspect eczématiforme du mamelon, qui peut démanger et même saigner 17. La maladie de Paget du sein ne doit pas être confondue avec la maladie métabolique osseuse également appelée maladie de Paget 18.
Tumeurs phyllodes et sarcomes mammaires
Les tumeurs phyllodes représentent entre 0,3 et 1% des tumeurs du sein, constituant la forme la plus commune de sarcome du sein 20, 21. Il s’agit de tumeurs fibro-épithéliales présentant les caractéristiques d’un fibroadénome mais avec une composante conjonctive hypercellulaire prépondérante 21.
Classification des tumeurs phyllodes : Elles se classent en trois catégories selon leur degré de malignité : bénignes (60 à 70% des cas), borderlines (à malignité restreinte), et malignes (moins de 5%) 22, 23. Les formes malignes (grade 3) “sarcomes phyllodes” font partie des sarcomes primitifs du sein 21.
Caractéristiques cliniques : Ces tumeurs se présentent sous la forme d’un nodule ferme, d’accroissement rapide, dont le temps de doublement est souvent inférieur à 3 mois 20. L’âge de survenue varie de 15 à 60 ans, avec un âge moyen de 45 ans, soit environ 20 ans plus tard que les adénofibromes 20. Les tumeurs phyllodes sont bilatérales dans 30% des cas 20.
Le risque de récidive de la tumeur phyllode bénigne est de 5 à 15%, nécessitant une exérèse complète et un suivi régulier 22. La tumeur phyllode maligne peut se propager à d’autres organes, le plus souvent les poumons 22.
Classification moléculaire moderne

La classification moléculaire contemporaine, basée sur l’analyse génomique PAM50, reconnaît au moins quatre sous-types distincts de cancers du sein invasifs correspondant à des pronostics et traitements différents 26. Cette classification s’appuie sur le concept d’arbre hiérarchique du développement mammaire normal, depuis les cellules souches indifférenciées jusqu’aux lignées spécialisées 26.
Sous-types luminaux : Les cancers luminaux A et B expriment des récepteurs hormonaux et correspondent à des cancers généralement de pronostic favorable 12, 26. Le sous-type luminal A (bien différencié, bas grade) répond favorablement à l’hormonothérapie, tandis que le luminal B (plus prolifératif) nécessite souvent une approche combinée 12.
Sous-type HER2-enrichi : Caractérisé par une forte expression de HER2 et des gènes de l’unité d’amplification 17q12, ce sous-type bénéficie des thérapies ciblées anti-HER2 comme le trastuzumab ou les inhibiteurs de tyrosine kinase 12.
Sous-type basal : Correspondant majoritairement aux cancers triple négatifs, ce sous-type se caractérise par un haut grade histologique, une forte prolifération et l’expression de gènes du cycle cellulaire 12. Il présente fréquemment des mutations de TP53 et nécessite des approches thérapeutiques spécialisées incluant l’immunothérapie 12.
Cette classification moléculaire permet une approche personnalisée du traitement, chaque sous-type ayant ses spécificités biologiques et sa sensibilité thérapeutique propre 26
Chirurgie
Chirurgie conservatrice (tumorectomie)
La chirurgie conservatrice, également appelée tumorectomie, constitue aujourd’hui le traitement de première intention pour la majorité des cancers du sein lorsqu’elle est réalisable 12. Cette approche thérapeutique est possible dans environ 70% des cas et permet de préserver le sein tout en assurant un contrôle oncologique optimal 23. Le traitement conservateur consiste à réaliser l’exérèse chirurgicale de la totalité de la tumeur avec des marges de sécurité tout en conservant le maximum de tissu mammaire sain 1.
Cette technique présente une équivalence en termes de survie globale par rapport au traitement radical, ce qui en fait le standard de soins actuel 2. La tumorectomie nécessite généralement une radiothérapie complémentaire pour diminuer le risque de récidive locale et optimiser le contrôle carcinologique 12. Les indications de la chirurgie conservatrice dépendent principalement du rapport entre la taille de la tumeur et le volume du sein, de son caractère unifocal ou multifocal, ainsi que des préférences de la patiente 2.
Contre-indications à la chirurgie conservatrice : Les principales contre-indications incluent les tumeurs multifocales ou inflammatoires, l’impossibilité de recevoir une radiothérapie adjuvante, les récidives locales, et les cancers n’ayant pas répondu à une chimiothérapie néoadjuvante effectuée à visée de conservation mammaire 2. Dans les cas où la taille tumorale est importante par rapport au volume du sein, un traitement néoadjuvant peut être proposé pour réduire la taille tumorale et permettre un geste conservateur 2.
Mastectomie
La mastectomie reste indiquée dans environ 20 à 30% des cancers du sein, sa réalisation étant davantage liée à la forme du cancer qu’à sa gravité 4. Les indications incontournables de mastectomie comprennent les tumeurs multicentriques, les cancers localement avancés, les récidives locales, le carcinome intra-canalaire diffus, et les souhaits exprimés par la patiente 3.
Indications spécifiques : La mastectomie est particulièrement indiquée en cas de cancer multifocal, de mutation prédisposante au cancer du sein (BRCA1 et 2) dans le cadre d’une chirurgie prophylactique, de sein inflammatoire après chimiothérapie première, et lorsque le rapport volume tumoral/volume du sein n’est pas favorable à un traitement conservateur 2. Elle peut également être proposée en cas de réduction tumorale insuffisante après chimiothérapie, de chirurgie de rattrapage quand les marges sont incomplètes sans possibilité de reprise chirurgicale élargie, ou en présence de certaines contre-indications à une radiothérapie postopératoire 2.
Innovations françaises en chirurgie
Technique du ganglion sentinelle : Cette innovation majeure révolutionne la prise en charge chirurgicale des cancers du sein en évitant le curage ganglionnaire systématique 5. La technique du ganglion sentinelle s’appuie sur le repérage du premier ganglion susceptible d’être atteint par l’extension tumorale, initialement développée pour les cancers du sein et adaptée à d’autres localisations 5. Cette approche permet une chirurgie ambulatoire, évite les séquelles liées à l’étendue de la cicatrice, les séquelles nerveuses, et prévient le lymphœdème 5.
Chirurgie oncoplastique : Cette innovation française combine l’expertise carcinologique et les techniques de reconstruction esthétique pour optimiser les résultats tant sur le plan oncologique que cosmétique 2. La chirurgie oncoplastique permet de traiter des tumeurs de plus grande taille tout en préservant l’esthétique mammaire grâce à des techniques de remodelage et de reconstruction immédiate 2. Cette approche multidisciplinaire nécessite une coordination étroite entre chirurgiens oncologues et plasticiens pour garantir des résultats optimaux 2.